Review: The Role of Hyperthermia in Treating Pancreatic Tumors
Martin Roesch & Boris Mueller-HuebenthalIndian J Surg Oncol (March 2015) 6(1):75–81
תקציר
קיים רק שיפור שולי בתוצאות הטיפול בסרטן הלבלב בשני העשורים האחרונים. זה הזמן להיפתח ולהתבונן מחדש באפשרויות הטיפול המשלים האדג'ובנטי. היפרתרמיה עשויה להיות אחת מאפשרויות אלו. הזלפת כימותרפיה היפרתרמית לחלל הצפק (HIPEC) בעיקר כהליך ניתוחי כבר הוכיחה את ההצדקה שלה. היפרתרמיה אזורית לא פולשנית כטיפול משלים לכימותרפיה או לקרינה עדיין לא הגיעה למצב דומה של ראיות. עם זאת הפוטנציאל לגדול בסופו של דבר לתוך ראיות כאלה כבר ניתן להבחין בבירור. סקירה זו מציגה את המתודולוגיות השונות הזמינות עבור היפרתרמיה, מכסה את הנתונים הקליניים הראשוניים שפורסמו ונותן תחזית למה שניתן לצפות ב-2-3 השנים הבאות. להיפרתרמיה יש פוטנציאל להאריך משמעותית את תוחלת החיים וזאת תוך שמירה על איכות חיים מספקת!
מבוא
גידול בלבלב עדיין מהווה אבחנה קטלנית עבור רוב החולים. ניתוח נחשב לתרופה היחידה, בתנאי שהמחלה נמצאת השלב המוקדם שלה. עם זאת, רוב החולים החדשים המאובחנים לאחרונה כבר נמצאים בשלבים מתקדמים ונחשבים ללא נתיחים. לחולים אלו תוחלת חיים ממוצעת של 6-7 חודשים לאחר האבחנה הראשונה.
הטיפול המקובל כיום הוא כימותרפיה על-ידי gemcitabine, שבסופו של דבר ניתנת בשילוב עם erlotinib. ניסויים שנערכו לפני מספר שנים הצביעו על עליונותה של gemcitabine על פני תרופות ציטוסטטיות אחרות. אבל, כימותרפיה משולבת לא הצליחה לשפר את התוצאות עם Gemcitabine כמונותרפיה. לאחרונה, לעומת זאת, משטר טיפולי רב-תרופתי נראה כי מצביע על עליונות (11.1 חודשים) על פני gemcitabine לבד (6.8 חודשים במקרה הטוב) ביחס לשיעור ההישרדות. מכיוון שמדובר בהתפתחויות אחרונות, לצורך הערכת השימוש המשלים בהיפרתרמיה, רוב הנתונים מושווים לטיפול בגמציטאבין בלבד או בתוכנית טיפול של gemcitabine/קרינה. עם זאת, תוחלת ההישרדות לא עלתה במידה ניכרת בעשור האחרון. גידולי לבלב עדיין נותרו כמחלה המתקדמת במהירות עם שיעור הישרדות נמוך מאוד. לפיכך נותר הצורך לסרוק ולהעריך באופן ביקורתי את אפשרויות הטיפול האדג'ובנטי בעיקר על פי שני קריטריונים: (1) פוטנציאל להאריך את שיעור ההישרדות, ו(2) פוטנציאל להשיג או לשמר על רמה מספקת באיכות של חיים.
להיפרתרמיה כאפשרות לטיפול משלים יש את פוטנציאל לעמוד בשני הקריטריונים הללו בציפייה של יחס אטרקטיבי ברווח הישרדות/תופעות לוואי שוליות נוספות. הפרקטיקה הקלינית כיום בהחלט אינה עומדת בצפיות של הפוטנציאל הזה.
טכניקות ומתודולוגיות בהיפרתרמיה
ישנן מגוון רחב של שיטות וטכנולוגיות חימום שונות. אלו הרלוונטיות לטיפולי לבלב יהיו יסווגו ויתוארו בבוא העת, ויוערכו בקצרה למצבם הנוכחי בפרקטיקה הקלינית. סיווג ראשון יהיה להבדיל בין חימום מקומי-אזורי וחימום של כל הגוף.
חימום כל הגוף מושג על ידי שני עקרונות:
- המטופל מונח מתחת למנורת אינפרה-אדום עם מסנן מים, עטופות ומחוממות (שיטה קלאסית).
- המטופל מוכנס לאמבט מים חמים (עד 44 מעלות צלזיוס), מתן הרגעה וצוות קרדיו/טיפול נמרץ מיועד לפקח על הטיפול (שיטה חדשנית ממוצא רוסי: Heatheal).seed phase).
היפרתרמיה מקומית-אזורית נחשבת כאפשרות הטיפול העיקרית. גם כאן, כדאי להבדיל בין השיטות המגוונות הזמינות:
- חימום שטחי (תוך ניתוחי).
- חימום בין-רקמתי/לתוך חללים פנימיים (interstitial/intraluminal).
- חימום אזורי עמוק לא פולשני.
חימום שטחי תוך-ניתוחי (Intraoperative Superficial Heating)
למרות שהרעיון של חימום ישיר בשלב התוך-ניתוחי עשוי להישמע מבטיח, הוא מבוצע לעתים רחוקות מאוד. ביקורת שהועלתה לפני כ-20 שנה, הייתה אודות חוסר היכולת לכאורה ליצור מספיק חום של פני השטח. קבוצה יוונית פרסמה נתונים מבטיחים על מקרים פליאטיביים בלתי-ניתנים לניתוח, על-ידי תכנית מרובת לוחות זמנים של כימותרפיה בשילוב הקרנות (45 Gy) בתוספת טיפול אחד של היפרתרמיה במהלך ניתוח מעקפים. היפרתרמיה בוצעה בתדר של 433 מגה-הרץ שלמעשה מתאים לחימום יעיל של שטח הפנים. הממצא שלהם ציין באופן משמעותי כי בקבוצה שכללה היפרתרמיה, חלה הפחתה בכאב ושיפור באיכות החיים. (התוצאות הקליניות מסוכמות בטבלה 1).
להלן טבלה 1: ניסויי סקר על טיפולים בסרטן הלבלב כולל היפרתרמיה
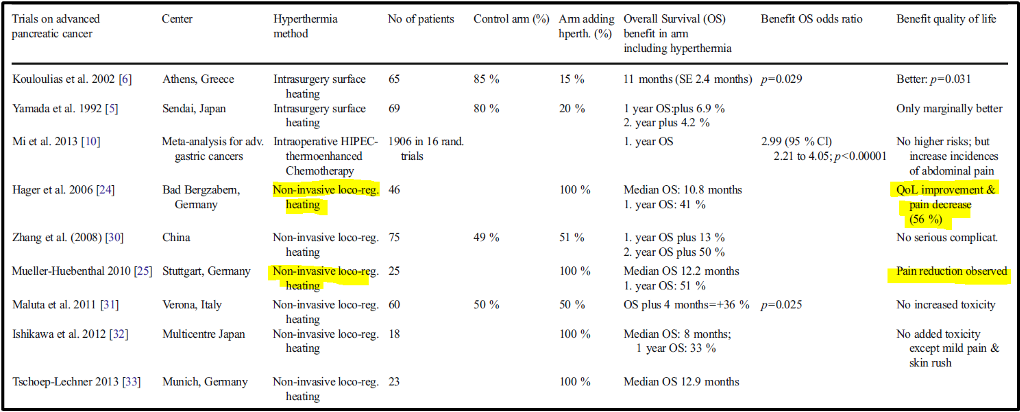
חימום בין-רקמתי/לתוך חללים פנימיים/HIPEC (Interstitial/Intraluminal)
חימום בין-רקמתי הוא, שוב, אפשרות טיפול נדירה למדי גם היום. Nakagawa (1996) מדווח על הצלחה ביישום תרמוקואגולציה (thermocoagulation) סלקטיבית בגידולים שאינם ניתנים לניתוח המכוונים ל-50 מעלות צלזיוס באזור העניין (כ-2 cm3) ו-40 מעלות צלזיוס באזור הסמוך. עם זאת, התוצאות הן אך ורק על בסיס המקרה, בעוד שאף ניסוי לא בוצע. למרות זאת, ניתן לייחס תפקיד חשוב לכימותרפיה היפרתרמית תוך פריטונאלית (HIPEC) בעיקר בשילוב עם ניתוח מפחית תאים (Cytoreductive surgery). תמיסות ציטוטוקסיות אשר יעילותן משתפרת באמצעות חימום, אינן מוגבלות למתן רק בניתוחי בטן פתוחים גדולים אלא מבוצעים גם לאחר הניתוח כהמשך טיפול. יש רציונל חזק לשימוש בHIPAC, תוך כדי הניתוח ולאחר ניתוח כהמשך טיפול. Sugerbaker ואח', ציינו: "החשיפה של שטח הצפק ל gemcitabineתוך-צפקי היא בערך פי 200-500 מהחשיפה המתרחשת בתוך הפלזמה". אמנם ישנן עדויות רבות המראות את עדיפות הטיפול ב-HIPEC על פני שיטות קונבנציונליות בטיפול ממאירויות בחלל הצפק שמקורן מהמעי הגס, במיוחד בסרטן הלבלב, אך טרם פורסמו ניסויים עבור שיטה זו. Mi ואח'. ערכו מטה-אנליזה יסודית של HIPEC תוך-ניתוחי עבור סרטן קיבה מתקדם, כולל 16 מחקרים אקראיים שכללו 1,906 חולים. החוקרים מסכמים: "בהשוואה לניתוח בלבד, טיפול משולב (ניתוח בתוספת IHIC) היה קשור לשיפור משמעותי בשיעור ההישרדות לאחר שנה.
(Hazard ratio (HR)= 2.99; 95 % confidence interval (CI)=2.21 to 4.05; p<0.00001), 2 years (HR=2.43; 95 %CI=1.81 to 3.26; p<0.00001), 3 years (HR=2.63; 95 %CI=2.17 to 3.20; p<0.00001), 5 years (HR=2.49; 95 %CI=1.97 to 3.14; p<0.00001), and 9 years (HR=2.14; 95 %CI=1.38 to 3.32; p=0.0007)”
HIPEC במהלך הניתוח, כפי שהכותבים מרחיבים עוד, לא היה קשור בסיכון גבוה יותר, אך העלה את השכיחות של כאבי בטן (RR=21.46; 95 %CI=5.24 to 87.78; p<0.00001). בהתחשב במטא-אנליזה הנרחבת של כותבים אלה, שיטה זו של היפרתרמיה לא תוערך עוד יותר. אחרון חביב, זו היא הגישה החדשנית המשתמשת בחלקיקים מבוססי-ברזל (ferrobased nanoparticle) המוזרקים לאזור הגידול ובהמשך, מחוממים על ידי הפעלת שדה מגנטי לסירוגין. ישנם כמה מקרים מחקריים ראשוניים המיושמים בסרטן הלבלב. השיטה, לעומת זאת, התחילה עם גליומה וסרטן הערמונית (Magforce).
חימום אזורי עמוק לא-פולשני (Non-invasive Deep Regional Heating)
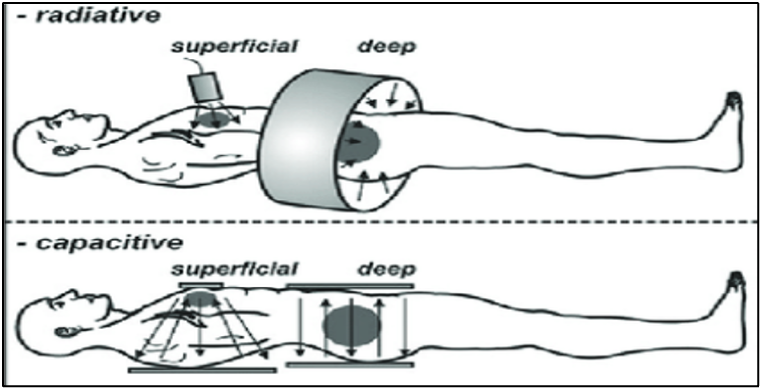
חימום אזורי עמוק לא-פולשני היא שיטת החימום הנוספת שרלוונטית מבחינה קלינית. במהלך דיונים על היפרתרמיה בסרטן הלבלב, לרוב מתייחסים לקטגוריה זו. כיום, קיימות בעצם שתי טכנולוגיות זמינות לצורך חימום בטווח הטמפרטורות של 39-44 מעלות צלזיוס. אלה הן: (1) קרינתיות, הנקראות מערכות אנטנה (antenna systems). (2) מערכות קיבוליות (capacitative systems) (איור 1). בנוסף, קיים אולטרסאונד ממוקד (HIFU-focused ultrasound) כשיטה של אבלציה תרמית לא פולשנית, בדרך כלל בשילוב עם MRI לבקרת מיקום ומדידות טמפרטורה. אולטרסאונד ממוקד הוא טיפול חדשני ולטיפול בלבלב נמצא עדיין בשלבי התהוות, מכיוון שטכניקה זו בעצם מחליפה את השיטה הכירורגית ובשלב זה אינה מיושמת לחימום אדג'ובנטי, היא לא תכוסה בטקסט זה.
התדרים המיושמים נעים בין 8 ל-24 מגה-הרץ; למעשה, ככל שהתדר נמוך יותר כך יכולתו לחדור לעומקם של מבנים שמים הם המרכיב הדומיננטי, כמו גוף האדם, טובה יותר. כך במצב בו כל התנאים שווים 20MHz מגיעים עמוק יותר מ-100 MHz; לעתים קרובות מערכות משתמשות ב-13.56 מגה-הרץ מכיוון שזהו טווח תדרים פתוח שאינו מצריך כלוב פאראדיי למיגון, על ידי כך מוזלים עלויות.
להלן איור 1- Radiative and capacitative techniques for non-invasive loco-regional heating
מגבלות
קיימות מגבלות לחימום מספיק טוב. זה חל פחות או יותר על כל השיטות הלא פולשניות. מגבלה אחת היא הכנסת השפעת החום לאזור העניין. הלבלב ממוקם במרכז הגוף; המשימה היא למנוע מהרקמות הסמוכות לאזור מלספוג יותר מדי מהאנרגיה, מה שעלול לדחוק בגבול הסיבולת של המטופל להשפעה אנרגטית מספקת. לכן לחולי מחלת אדיפוס, יש חיסרון, שכן חלק גדול מהאנרגיה המיושמת נספגת בשומן. עבור אזור הלבלב, לעומת זאת, זה פחות רלוונטי להבדיל מאזור הבטן התחתונה. מח עצם הוא רקמה הרגישה להשפעות השדה אלקטרומגנטי. כאב בקשת הצלעות התחתונה ובעצם הסטרנום עובד לעתים קרובות כצוואר בקבוק לאנרגיה המשוקעת שרצויה. יחד עם זאת, קיימים אמצעים פרוצדורליים המאפשרים להתגבר על הגבלות כאלה במידה רבה.
פרפוזיית כלי הדם היא ההגבלה העיקרית השנייה. השפעת החום מולכת על ידי זרימת הדם, ודם חדש שזורם פנימה למעשה מקרר את הרקמה ליד הכלים הגדולים. מכיוון שהזילוף ברקמות הגידול הוא מאוד לא סדיר, כך גם השפעה זו, ועשויה להניב תוצאות שונות מאוד מטיפול חימום אחד לאחר Kandel ואח'. השתמשו ב-CT נפח דינמי (dynamic volume CT) כדי לעקוב אחר זלוף של כל הלבלב ב-30 חולים. הם דיווחו על השפעה סלקטיבית לטובת היפרתרמיה, תוך הבחנה שבקרצינומות של הלבלב הזילוף נמוך משמעותית מזה של רקמת לבלב רגילה (P<0.001). הבעיה באה לידי ביטוי עד כה, לאור העובדה שקשה להשיג מדידות טמפרטורה ישירות באזור זה לצורך בקרת איכות. אם כך ברוב המקרים, החימום מתבצע ללא משוב טמפרטורה על מנת לשמור על האיכות היעילות. ההצדקה עלולה להיות חלשה אולם בעלת טיעון: כנגד כל המגבלות של מיקום עמוק ופרפוזיית כלי הדם התוצאות הקליניות מדגימות יתרון ברור ביישום היפרתרמיה. לפיכך, ההשפעה חייבת להיות דבר מה פחות זניח. זה מעיד את הפוטנציאל שברובו לא מנוצל, אבל צריך לשכלל אותו על מנת לייעל את הליכי החימום ובסופו של דבר להתחיל למדוד טמפרטורות בתוך תריסריון(intraduodenal). טמפרטורות בתוך הגידול ובתוך חללי הגוף (Intratumoral and intraluminal) שהושוו באזור האגן מצביעות על כך שחלופה שכזו להיות מדויקת למדי.
הוספת היפרתרמיה כאפשרות טיפול אדג‘ובנטי בחולי סרטן הלבלב: רציונל ופרוטוקולים
רציונל ביולוגי אחד לטובת היפרתרמיה טמון בתצפית שלתאי גידול ממאירים עשויה להיות רגישות נמוכה יותר ללחץ תרמי להבדיל מתאים רגילים. יתרה מכך, נראה שלתאים סרטניים באופן כללי יש יינון גבוה יותר, ולכן הם פגיעים יותר לחימום אלקטרומגנטי. ניתן היה להדגים כי שקיעת אנרגיה מוגברת התרחשה ברקמת הגידול בלבלב בהשוואה לרקמת לבלב רגילה. הואיל וכך לתאי הגידול קיימת סלקטיביות גבוהה יותר לאפקט החימום. העובדה שגידולי הלבלב הם עם וסקולריזציה חלשה מקלה על ההשפעות הנוספות של חימום. עם חימום מקומי באזור העניין, זרימת הדם גדלה, הלחץ בין-הפרניכמות מופחת וחדירות של כלי הדם גדלה מעט באמצעות התרחבות החום. כל ההשפעות הללו מסייעות לזרימה טובה יותר של הציטוטוקסיקה לאזור העניין.
חום הוא סטרס לתאים, הם מגיבים על ידי סינתזה של חלבוני עקת חום (heat shock proteins). אלה שיישארו בתא מגוננים על התא הזה כנגד השפעות סטרס נוספות. סיבה זו היא ההסבר מדוע אין לבצע טיפולי היפרתרמיה בסמיכות. צריך לפחות יום אחד הפרש ביניהם. למרות זאת, חלבונים אלו שנחשפים על ממברנת התא החיצונית מתפקדים כגירויי למערכת החיסון של גוף. מחקרים מציינים על כך שטיפול בהיפרתרמיה במשטר משולב עם Gemcitabine יניב את השפעות הטובות ביותר כאשר ישנו פער זמנים של 24 שעות לפני או אחרי העירוי. בתרופות ציטוסטטיות אחרות כגון cisplatin נראה כי ההשפעה הטובה ביותר היא סמוך זמן לעירוי. עד כה לא קיימות ראיות שלהיפרתרמיה מתונה (עד 42 מעלות צלזיוס) יש השפעה מועילה כטיפול יחיד. עם זאת, מחקר על הפן האימונולוגי של היפרתרמיה הפך לתחום חדש שהופיע, עם תצפיות וממצאים מעניינים כמו שהיפרתרמיה משפיעה על החלבון קלרטיקולין (calrecitulin), שנראה כי הוא מתבטא בשלב המוקדם של החימום על קרום התא של תאי הגידול, ופועל כסיגנל למערכת החיסון של הגוף "לאכול אותו".
היפרתרמיה בשילוב עם קרינה –
משטרים טיפול רבים בגידולי לבלב נשענים גם על קרינה. היפרתרמיה נחשבת כמשפרת חזקה של השפעות הקרינה. יש סיכום טוב לנתונים פרה-קליניים וקליניים אלו. הרציונלי נשען על 4 נקודות: (1) תפקידה של היפרתרמיה להגביר את החמצון באזור העניין, (2) תפקידו של סטרס הנגרם מחום לעכב את מנגנון תיקון ה-DNA של התאים, ובכך לתקן את נזקי ה-DNA מקרינה, (3) ההשפעה המשלימה להארכה של עצירת מחזור התא בשלב G2 שהוא רגיש לקרינה. (4) השפעות נוספות הכוללות הגברת הגירוי החיסוני של תאים מציגי-אנטיגן ע"י תאים נקרוטים כתוצאה מהקרינה.
היפרתרמיה והפחתת כאב בחולי סרטן הלבלב –
בשלב הפליאטיבי, לעתים קרובות אפשר להפחית את מינון האופיאטים עד 5 ימים לאחר טיפול היפרתרמיה (לא אגרסיבי). Hager ואח', ציינו את הממצא של הפחתת כאב לאחר היפרתרמיה בניסויים שלהם בלבלב. Sridhar דן במחקר קטן ביישום היפרתרמיה בגידולי קיבה, שבו ל-8 מתוך 10 חולים בתום 6 שבועות הייתה הפחתת כאבים של יותר מ-80% ונמנעו ממשככי כאבים.
תחזית –
מחקר מבטיח הנעשה כיום, מערב ננו-חלקיקים עם שחרור מושהה וליפידים הרגישים לחום עם ציטוסטטיקה בעלת מעטפת . בעוד שדוקסורוביצין הייתה בין התרופות הראשונות שנבדקו בדרך זו, אחרות כמו cisplatin ו-gemcitabine נבדקו אחרי. ישנה אפשרות לתכנן את מבנה הליפידים כך שיהיו עם רגישות תרמית המשתחררים אך ורק בסף שנקבע מראש (למשל 38.5 מעלות צלזיוס). הרציונל הוא שניתן לתעל עירוי מערכתי לאזור העניין באמצעות חימום מקומי של סביבת הרקמה הספציפית. לטיפול בגידולי לבלב, זה עדיין לא הגיע לרלוונטיות קלינית .
סקירה של נתונים קלינים –
המתודולוגיות העיקריות של היפרתרמיה הקשורה ללבלב כעת הן כימותרפיה היפרתרמית תוך-פריטונאלית (HIPEC) וחימום אזורי עמוק לא-פולשני וחימום מקומי-אזורי. כפי שהוזכר קודם לכן, עבור HIPEC, האזכור הטוב ביותר הוא למטא-אנליזה של גידולי קיבה מתקדמים על ידי Mi ואח'. חלק זה מתרכז כעת בחימום אזורי עמוק לא-פולשני וחימום מקומי-אזורי. הניסויים הזמינים מראים מגוון רחב של משטרי טיפול עם ציטוסטטיקה שונה, מינונים שונים, כולל וללא קרינה ואותו מגוון באופן שבו יושמה היפרתרמיה. מצב זה אופייני לתחום שטרם הגיע לקונצנזוס ועדיין נמצא בשלב ניסוי. עם זאת, היתרון הקליני ברור למדי למרות וריאציות אלו. לצורך ניסויים, נסקר מסד הנתונים של PubMed ו-Cochraine ע"י החוקרים והמצגות בכנסים של היפרתרמיה אונקולוגית במשך 5 השנים האחרונות שמודעים להם. הניסויים שנמצאו בחימום אזורי לא פולשני יאופיינו בקצרה.
המחקר הגרמני (Hager et al. 2006) –
המחברים מציגים מחקר פרוספקטיבי של זרוע אחת על סרטן לבלב מתקדם שאינו ניתן לכריתה מלאה בניתוח. עם משטר טיפול מורכב הכולל טיפול אנזימים, טיפול אנטי-הורמונלי (טמוקסיפן, פלוטמיד, LH-RH Analoga), חומרים המווסתים את מערכת החיסון, חומרים הגורמים לדיפרנציאציה (מינון גבוה ויטמין A-E-palmitate, אלפא הידרוקסיקלציפרול, קומרינים), היפרפירקסיה אנדוגנית עם חיסון חיידקי מעורב והיפרתרמיה. אותם חולים שנמצאים בתהליך עם התקדמות של המחלה טופלו ב-5-FU; מיטומיצין C ואלפא-אינטרפרון(Mitomycin C and alpha-Interferon), שוב בשילוב עם היפרתרמיה. חציון ההישרדות הכוללת היה 10.8 חודשים עם שיעור הישרדות ב-5 שנים של 9% (לרוב פחות מ-2%). ניכר בפרט, כפי שמוסיפים המחברים: "רוב החולים חוו שיפור מצוין בחלקו באיכות החיים (עלייה בתיאבון ומשקל, שיכוך כאבים, שיפור במצב הכללי)". עבור היפרתרמיה, המחקר הוא בעל ערך מוגבל שכן, בשל המשטר הטיפולי הזר למדי, תוצאותיו אינן ניתנות למעקב סיבתי לאף מרכיב טיפול בודד.
המחקר הסיני (Zhang et al. 2008) –
ניסוי זה בסרטן לבלב מתקדם השווה קרינה שניתנה על ידי סכין גמא (gamma knife) (3–4.5 Gy, 8-11 מקטעים) כטיפול בודד לעומת טיפול אדג'ובנטי תרמו-כימותרפי במתן tegafur (0.5-1.0 גרם) ו calcium folinate (CF 0.2 גרם) כ4 -6 פעמים או – למרבה הצער זה לא מצוין בפירוט רב יותר – Gemcitabine (0.6-1.0 גרם/מ"ר) בימים 1 ו-8 וציספלאטין (DDP) (20-30 מ"ג/מ"ר) בימים 1-3, כל 28 ימים למשך 3-6 מחזורים. היפרתרמיה ניתנה פעמיים בשבוע ביום העירוי למשך שעה בשישה מקטעים. הישרדות כללית לשנה אחת (OS) בקבוצת השילוב התרמו-כימוי הייתה 51.2% בהשוואה ל-45.2% בקבוצת הקרנות בלבד והישרדות כללית של שנתיים הייתה 26.5% בקבוצה המשולבת לעומת 17.6% לקבוצת קרינה בלבד. המחברים מדווחים על כך לא נצפו סיבוכים רציניים כגון פרפורציה, דימום או חום גבוה לא בשלב הטיפול ולא במעקב. ברור לציין שזרוע הביקורת בטיפול כללה שני הליכים נוספים (כימותרפיה בתוספת היפרתרמיה) במקום אחד.
המחקר גרמני השני (Mueller-Huebenthal 2010) –
מחקר רטרוספקטיבי זה כלל 25 חולים עם אדנוקרצינומה מקומית מתקדמת (5 חולים) או גרורות (20 חולים) של הלבלב. כל החולים קיבלו כימותרפיה סטנדרטית מבוססת gemcitabine בשילוב עם של היפרתרמיה מקומית-אזורית למשך שעה אחת פעמיים בשבוע. מצב הביצועים של ECOG השתנה בין 0 ל-1. חציון ההישרדות הכולל הדגים 12.2 חודשים (לעומת 6-7 חודשים צפויים). שלושה חולים הראו תגובה מלאה (CR), שבעה חולים תגובה חלקית (PR), חולה אחד עדיין בחיים (נכון ל2014). לפיכך שליטה במחלת הסרטן (CR+PR+SD) הייתה 65% והישרדות לשנה 51% (לעומת הצפויה 25%) תופעות לוואי שליליות עקב הוספת היפרתרמיה לא זוהו. למרות שלא תועד באופן שיטתי, הייתה תצפית של הפחתת כאב בחלק מהחולים.
המחקר האיטלקי (Maluta et al. 2011) –
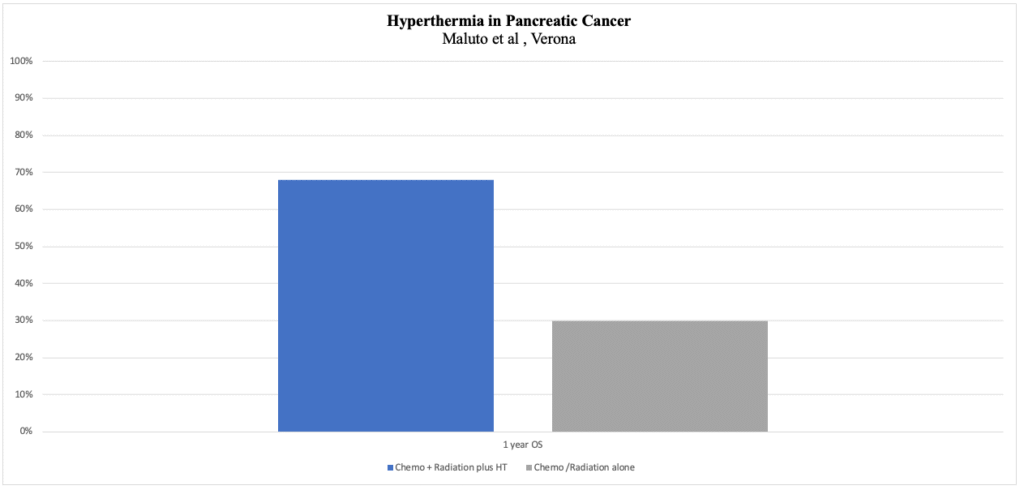
הבסיס היה טיפול משולב בקרינה (מ-30 Gy /10 מקטעים ל-66 Gy /33 מקטעים) עם כימותרפיה(CT).CT כללה Gemcitabine לבד או בשילוב עם אחד מהבאים oxaliplatin, cisplatin או 5-FU. היפרתרמיה ניתנה פעמיים בשבוע בימי קרינה. הישרדות כללית חציונית הייתה 15 חודשים בהשוואה ל-11 חודשים בקבוצת הביקורת (p=0.025). היפרתרמיה, מוסיפים המחברים, לא הגבירה את הרעילות של טיפול כימותרפי/קרינה. ביקורת על ניסוי זה מתייחסת למשטר הטרוגני של כימותרפיות שונות.
המחקר היפני (Ishikawa et al. 2012) –
לחולים ניתן Gemcitabine 1,000 מ"ג/מ"ר בימים 1, 8 ו-15 כל 4 שבועות. היפרתרמיה מקומית-אזורית (capacitative system) ניתנה פעם בשבוע, יום לפני עירוי הגמציטבין. חציון ההישרדות הכללית (OS) היה 8 חודשים, אך במקרים של חולי לבלב מקומי מתקדם, זה היה 17.7 חודשים ובמקרים של גרורות בלבלב, 5.2 חודשים. שיעור התגובה (תגובה חלקית (PR)) יחד עם מחלה יציבה (SD) דווח על 61%. לפיכך, התוצאות היו בבירור עדיפות על מה שהיה צפוי בטיפול כימותרפי של Gemcitabine.
המחקר הגרמני ה-2 (Tschoep-Lechner et al. 2013) –
מחקר רטרוספקטיבי זה החל כקו טיפול שני לאחר כישלון בטיפול בגמציטאבין. המטופלים קיבלו Gemcitabine 1,000 מ"ג/מ"ר ביום הראשון בשילוב עם ציספלטין 25 מ"ג/מ"ר בשילוב עם חימום קרינתי לא פולשני מקומי-אזורי ביום 2 ו-4, מדי שבוע למשך 4 חודשים. הזמן החציוני להתקדמות שניה של המחלה היה 4.3 חודשים ((95 %CI: 1.2–7.4) הישרדות כללית חציונית היה 12.9 חודשים (95 %CI: 9.9–15.9) שיעור בקרת המחלה של חולים עם סריקות CT זמינות היה 50%.
The ESHO HEAT Phase III Trial (Hyperthermia European Adjuvant Trial – גיוס פתוח 2014 –
למרות שזהו ניסוי מתמשך בשלב מוקדם, ולכן אין תוצאות זמינות, עדיין יש להזכיר אותו מכיוון שזה יהיה הניסוי האקראי הראשון בקנה מידה גדול, להיפרתרמיה בטיפול בסרטן הלבלב. זרוע הבקרה שמה טיפול בודד של Gemcitabine לעומת טיפול מוגבר כולל Gemcitabine (1,000 מ"ג/מ"ר בימים 1 ו-15 q4w), cisplatin (25 מ"ג/מ"ר בימים 2, 16 q4w) בתוספת היפרתרמיה מקומית-אזורית (שעה אחת בימים 2,16 q4w) עם חולי לבלב R0/R1 שנכרתו. מגוון תכנוני הניסוי המסוכמים בטבלה 1 הוא מגוון למדי. ועדיין, על פני 2,287 חולים, יש עדויות ברורות לתועלת ההישרדותית של הוספת היפרתרמיה לכל סוג של משטר שהשווה. אפילו אם השאירו את השיטות התוך-כירורגיות מחוץ לשיקול דעת, יש עדויות עקביות לאורך 6 ניסויים כולל 247 חולים. לראות את הפוטנציאל של הפחתת כאב במחקרים שהוזכרו בעיקר לא היה המטרה העיקרית; ניסויים עתידיים צריכים לשמור על פרספקטיבה פתוחה לנושא זה, שכן יש לו פוטנציאל להניב ראיות מבטיחות.
מסקנות
למרות שהנתונים הקיימים כיום הם הטרוגניים ובחלקם ניתנים לביקורת מתודולוגית, הם עדיין מצביעים על יתרון ברור של היפרתרמיה אדג'ובנטית בהארכת ההישרדות הכוללת. מלבד מקרים של כאבי בטן בשיטת HIPEC, איכות החיים אף משתפרת על ידי הוספת היפרתרמיה. הציפיות הן שהניסוי האירופי הפרוספקטיבי אקראי שלב 3 HEAT שמתמשך יניב תובנות חשובות. אם כי אפשרות טיפול זו היא עדיין חדשה למדי, והניסויים שהוזכרו מיישמים תוכניות טיפול שונות, על אף כל הווריאציות, כולם מדגימים תוצאות מועילות ברורות המעידות על הפוטנציאל הטמון בהיפרתרמיה כאופציה נוספת לטיפול אדג'ובנטי ופליאטיבי.



