Hyperthermia for locally advanced breast cancer
International Journal of Hyperthermia, 2010, vol. 26:7, 618-624
Timothy M. Zagar1, James R. Oleson1, Zeljko Vujaskovic1, Mark W. Dewhirst1, Oana I. Craciunescu1, Kimberly L. Blackwell3, Leonard R. Prosnitz1 and Ellen L. Jones2
- Department of Radiation Oncology, Duke University Medical Center, Durham, North Carolina
- Department of Radiation Oncology, University of North Carolina Cancer Hospital, Chapel Hill, North Carolina, USA
- Department of Medicine, Division of Medical Oncology, Duke University Medical Center, Durham, North Carolina
תקציר
להיפרתרמיה (Hyperthermia) יש יתרון מוכח לטיפול בממאירויות שטחיות (superficial malignancies), במיוחד הישנות של סרטן השד בדופן בית החזה (chest wall recurrences). היו פחות מחקרים שהשתמשו בהיפרתרמיה במטופלות עם סרטן שד מתקדם מקומית (locally advanced breast cancer), אך הנתונים הזמינים מבטיחים.
היפרתרמיה שולבה עם כימותרפיה ו/או טיפולי הקרנות במסגרות הניאו-אדג'ובנטיות (neoadjuvant), הדפיניטיביות (definitive) והאדג'וונטיות (adjuvant), אם כי בסדרות מחקר (series) עם מספר קטן של מטופלים. קיים רק ניסוי פאזה 3 אחד שבוחן את ההיפרתרמיה בסרטן שד מתקדם מקומית (LABC), גם הוא עם מספר קטן יחסית של מטופלות.
מטרת סקירה זו היא להדגיש מחקר חשוב העושה שימוש בהיפרתרמיה בחולות עם סרטן שד מתקדם מקומית (LABC), כמו גם להציע כיוונים עתידיים לשימוש בו.
מבוא
מטופלות עם סרטן שד מתקדם מקומית (LABC) מהוות אוכלוסייה הטרוגנית. בעוד שהם סווגו בתחילה כסובלות ממחלה הבלתי ניתנת לניתוח (inoperable disease), לאחרונה, המונח סרטן שד מתקדם מקומית (LABC) יושם על חולות עם מחלה בשלב IIB-IIIC. הטיפול בחולים אלה התפתח עם השנים וכיום מורכב לרוב מכימותרפיה ניאו-אדג'ובנטית ולאחריה כריתה כירורגית כאשר הדבר אפשרי, עם טיפולי קרינה אדג'ובנטיות (adjuvant radiotherapy) וטיפול הורמונלי במידת הצורך. לפני השימוש בטיפול בגישה המשולבת (combined modality), דווח על שיעורי הישרדות של 25% עד 45% לחמש שנים (five-year survival rates). עם טיפולים מודרניים יותר, שיעור זה דווח על עד 80% עבור חולים עם מחלה בשלב IIIA ו-45% עבור חולים עם מחלה בשלב IIIB, מה שעדיין פחות משביע רצון.
בתוך תת-קבוצה של סרטן שד מתקדם מקומית (LABC), המטופלות עשויות לנוע בין מחלה בדירוג T3N0 הניתנת לכריתה לבין מחלה בדירוג T4N2 שאינה ניתנת לניתוח. עבור האפשרות השנייה, אין סטנדרט של טיפול, והטיפול עשוי לכלול מגוון של תרופות כימותרפיות/הורמונליות עם או בלי טיפול בהקרנות, מתוך תקווה לשפר את האפשרות לכריתה (resectability). עבור מטופלים היכולים לעבור כריתה כירורגית (surgical resection), שיעור התגובה הפתולוגית המלאה (pathologic complete response) הודגם כנמצא בקורלציה מובהקת עם שיפור בהישרדות הכוללת (overall survival). להיפרתרמיה (HT) יש פוטנציאל להגדיל את שיעור התגובה הפתולוגית המלאה (pCR).
טיפול בכימורדיותרפיה במקביל (concurrent chemoradiotherapy)
הרציונל לשימוש בכימורדיותרפיה במקביל הוא חזק, ונעשה בו שימוש במספר אתרים אחרים, כולל סרטן הראש והצוואר, סרטן הריאות וסרטן גינקולוגי (gynaecological cancers). הוכח כי דוסטאקסל (docetaxel), פקליטקסל (Paclitaxel) ופלואורואורציל (5-fluorouracil) מתפקדים כסנסטיזטורים לקרינה (radiation sensitisers) בסרטן השד. שלושים מטופלות עם סרטן שד מתקדם מקומית (LABC) שאינו ניתן לכריתה ניתוחי (unresectable) טופלו בפלואורואורציל (5-fluorouracil) ובטיפולי הקרנות במקביל למינון של כ-50 Gy באוניברסיטת דרום קליפורניה (University of Southern California). כל המטופלות עברו כריתת שד (mastectomy) עם סגירת עור ראשונית (primary skin closure). הם השיגו שיעור תגובה פתולוגית מלאה (pCR) (המוגדרת ללא תאים גידוליים שיוריים) של 17% ולא דווחו על רעילות אקוטיות או מאוחרת בדרגה ≥ 3. עם מעקב חציוני של 22 חודשים, ההישרדות הגולמית ללא מחלות (crude disease-free survival) הייתה 83%; אף מטופל שהשיג תגובה פתולוגית מלאה (pCR) לא עבר הישנות בזמן האנליזה שלהם.
בוצעו שני ניסויים פרוספקטיביים בפאזה 1 או 2, באוניברסיטת שיקגו (University of Chicago), תוך שימוש בכימורדיותרפיה במקביל (paclitaxel ± vinorelbine) עבור סרטן שד מתקדם מקומית (LABC) בלתי ניתן לניתוח, כולל סרטן שד דלקתי (inflammatory breast cancer). המינון הטיפולי בהקרנות היה 60-70 Gy לשד ו-60 Gy למערכת הלימפה המנקזת (draining lymphatics); היא ניתנה על פי לוח זמנים של שבוע טיפול ושל שבוע חופש. מתוך 33 המטופלות שנחקרו, תת-קבוצה של 16 מטופלות סבלו מסרטן שד מתקדם מקומית (LABC) לא גרורתי והיא נותחה בנפרד. מתוך 16 מטופלות אלה, 13 (81%) עברו כריתת שד (mastectomy) לאחר השלמת הטיפול בכימורדיותרפיה במקביל, ולשבעה (44%) הייתה תגובה פתולוגית מלאה (pCR).עם מעקב חציוני של 44 חודשים, שלטה מקומית-אזורית אקטוארית (actuarial locoregional control) של ארבע שנים, הישרדות ללא מחלה (disease-free survival) והישרדות כוללת (overall survival) היו 83%, 33% ו-56%, בהתאמה. היו שתי רעילויות אקוטיות בדרגה 4 (נויטרופניה ועור), וארבעה סיבוכים מאוחרים בדרגה 3 (מפרק, לימפואדמה, ועור/תת עורי בשניים).
מספר סדרות נוספות טיפלו במטופלים עם פקליטקסל (paclitaxel) או דוסטקסל (docetaxel) ניאו-אדג'ובנטית במקביל לטיפול בהקרנות, עם המטרה של כריתה כירורגית. התגובה הפתולוגית המלאה (pCR) הוגדרה כללא סרטן פולשני שיורי בדגימה (no residual invasive cancer), אם כי עדיין יכולה להיות קרצינומה שאינה חודרנית (carcinoma in situ). שיעורי התגובה הפתולוגית המלאה (pCR) שדווחו נעו בין 16% ל-34%; רעילות אקוטית הייתה שכיחה יותר עם דוסטקסל (docetaxel) מאשר עם פקליטקסל (paclitaxel) – אך רעילויות בדרגה ≥ 3 היו נדירה. החוקרים הגיעו למסקנה כי טיפול משולב זה בטוח, והצדיק מחקר השוואתי נוסף עם כימותרפיה ניאו-אדג'ובנטית בלבד.
היפרתרמיה עבור סרטן שד מתקדם מקומית (LABC)
היפרתרמיה שולבה גם עם טיפול בהקרנות, במאמץ לשפר את השליטה המקומית, שחשובה במיוחד בתת-הקבוצה הבלתי ניתנת לניתוח של סרטן שד מתקדם מקומית (LABC). היכולת של היפרתרמיה להשפיע על תאים בשלב ה-S, לעכב תיקון נזקים תת-קטלניים ולשפר את החמצון הופכות אותה לטיפול אטרקטיבי לשילוב עם הקרנות ו/או כימותרפיה מתוך תקווה לסינרגיה (synergy). המטרה הסופית עם תוספת של היפרתרמיה לטיפול הסרטן שד מתקדם מקומית (LABC) היא שיפור הרג הגידול, אשר לרוב מוערך עם שיעור התגובה הקלינית המלאה (clinical complete response) או שיעור התגובה הפתולוגית החלקית (pathologic partial response), ואם המטופלת עוברת ניתוח, תגובה פתולוגית מלאה (pCR). בנוסף לביולוגיה המובנית של גידול אינדיבידואלי, השגת תגובה מלאה (CR) עם תרמורדיותרפיה (thermoradiotherapy) תלויה בגודל הגידול, במינון ההקרנות שבו נעשה שימוש וביכולת לחמם את הגידול בצורה ראויה, מה שעלול להיות מאתגר במיוחד עם מסת גידול גדולה (large burdens) של מחלה בלתי ניתנת לניתוח. היפרתרמיה הייתה יעילה למדי בטיפול בהישנות של סרטן השד בדופן בית החזה (סקירה בגיליון זה של כתב העת International Journal of Hyperthermia), והובילה את חלקם להשתמש בהיפרתרמיה במסגרת של סרטן שד מתקדם מקומית (LABC) (טבלה 1). רוב סדרות המחקרים המדווחים הם מחקרים של מוסד בודד או תיאורי מקרים אנקדוטליים (anecdotal case reports). המטרה של שימוש בהיפרתרמיה היא לשפר את שיעור התגובה הפתולוגית המלאה (pCR), אשר בתקווה יתורגם להישרדות ממושכת ללא מחלה (prolonged disease-free) ולהישרדות כוללת (overall survival).
להלן טבלה 1: סיכום של ניסויי היפרתרמיה נבחרים במסגרת של סרטן שד מתקדם מקומית (LABC).
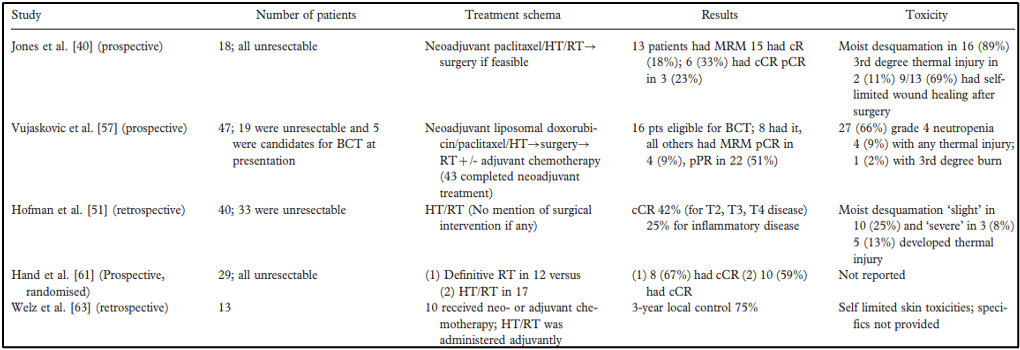
ראשי תיבות: HT – היפרתרמיה, RT – רדיותרפיה, MRM – כריתה נרחבת מותאמת של השד (modified radical mastectomy), cR – תגובה קלינית (חלקית או מלאה), cCR – תגובה קלינית מלאה, pCR – תגובה פתולוגית מלאה, BCT – טיפול משמר שד (breast conservation therapy), pPR – תגובה פתולוגית חלקית.
ניסוי פרוספקטיבי, בפאזה אחת או שתיים של מוסד יחיד מאוניברסיטת דיוק (Duke University), טיפל ב-18 מטופלות עם סרטן שד מתקדם מקומית (LABC) (כולל סרטן שד דלקתי) עם טיפול תרמו-כימורדיותרפיה (thermochemoradiotherapy) במקביל המבוסס על פקליטקסל (paclitaxel-based). טיפולי ההקרנות ניתנו במקטעים של-2 Gy למנה של 50 Gy לשד ולניקוז הלימפתי (draining lymphatics), עם היפרתרמיה אשר ניתנה פעמיים בשבוע. מטופלים שלא עברו כריתה כירורגית קיבלו תוספת של Gy 10 לבוסט (boost). מתוך 18 המטופלים, ל-15 הייתה תגובה קלינית אובייקטיבית (objective clinical response), מתוכם שישה (33%) נחשבו עם תגובה קלינית מלאה (cCR).
13 מהמטופלים הללו עברו כריתת שד (mastectomy) ושלושה מתוך ששת המטופלים עם תגובה הקלינית המלאה (cCR) היו עם תגובה פתולוגית מלאה (pCR) מתועדת (23%). שיעור זה של תגובה פתולוגית מלאה (pCR) דומה לסדרות מחקרים אחרות שדווחו של חולות סרטן שד מתקדם מקומית (LABC) שטופלו בכימורדיותרפיה במקביל (טווח 16%-44%). לא ברור אם המטופלים היו ניתנים להשוואה. ייתכן שהמטופלים של דיוק (Duke) היו יותר מתקדמים.
בנוסף ליעילות הטיפול והרעילות, נמדד חמצון הגידול (tumour oxygenation) לפני ו-24 שעות לאחר מפגש הטיפול הראשון של היפרתרמיה, על מנת לנתח כיצד היא תרמה לתוצאות הטיפול. באותם מטופלים שהיו להם גידולים היפוקסיים לפני הטיפול היה שיפור מובהק סטטיסטית בחמצון לאחר היפרתרמיה לרמות שכבר לא היו היפוקסיות. אותם מטופלים עם גידולים מחומצנים היטב בתחילה ואלה שתועד אצלם שיפור בחמצון, השיגו כולם תגובה קלינית מלאה (cCR) או תגובה קלינית חלקית (cPR). הרעילות במהלך הטיפול כללה קילוף לח של העור (moist desquamation) ב-16 או 18 מטופלים וכוויות בדרגה שלישית בשני מטופלים. מתוך 13 המטופלות שעברו כריתת שד (mastectomy), תשע סבלו מבעיות בריפוי הפצעים, אך בסופו של דבר כולן החלימו.
ניסוי פאזה 1 או 2 שפורסם לאחרונה על ידי דיוק (Duke) חקר את השימוש בדוקסורוביצין ליפוזומאלי (liposomal doxorubicin) ניאו-אדג'ובנטי, פקליטקסל (paclitaxel) והיפרתרמיה ב-47 מטופלות עם סרטן שד מתקדם מקומית (LABC), 14 (33%) ,מהן סבלו מסרטן שד דלקתי (inflammatory breast cancer). לאחר כריתה כירורגית, כל המטופלים קיבלו טיפול קרינתי אדג'ובנטי, וכל אלה שלא השיגו תגובה פתולוגית מלאה (pCR) קיבלו כימותרפיה נוספת. שיעור התגובה הקלינית המשולבת (תגובה מלאה (CR) ותגובה חלקית (PR)) עמד על 72%; ארבעה (9%) מטופלים השיגו תגובה פתולוגית מלאה (pCR). לאותם מטופלים שהשיגו תגובה פתולוגית מלאה (pCR) היו דקות שוות ערך מצטברות גבוהות יותר (cumulative equivalent minutes 43) ב-T90 (האחוזון עשירי של התפלגות הטמפרטורה) (ממוצע 28.6 דקות לעומת 10.3 דקות, p = 0.038) מאשר אלה שלא.
החוקרים הניחו כי שיעור התגובה הפתולוגית המלאה (pCR) שלהם היה נמוך יותר ממה שנראה עם מונותרפיה של טקסנים (taxanes monotherapy) ניאו-אדג'וונטים (∼26%, טווח 11%-31%), בשל ההבדל במטופלים שנחקרו; NSABP B27 גייסה מטופלים עם גידולים בדירוג T1-3, בעוד שבניסוי זה היו בעיקר נגעים בדירוג T3/T4, כאשר כמעט כשליש מהם סבלו מסרטן שד דלקתי (inflammatory breast cancer). למרות המחלה האגרסיבית יותר, שיעורי ההישרדות ללא מחלה לארבע שנים (four-year disease-free) ושיעור ההישרדות הכוללת (OS) היו סבירים למדי ועמדו על 63% ו-75%, בהתאמה. כפי שניתן היה לצפות במשטר הכימותרפיה האינטנסיבי הזה, רעילות המטולוגית (haematological toxicity) הייתה משמעותית, כאשר 27 (66%) מטופלים פיתחו נויטרופניה (neutropenia) בדרגה 4. רק ארבעה (9%) מטופלים חוו פציעה תרמית.
בנוסף לנקודות הקצה הקליניות-פתולוגיות (clinicopathological) שדווחו בניסוי, החוקרים גם ניתחו באופן פרוספקטיבי מספר גורמים מנבאים פוטנציאליים (potential predictors) לתגובת הטיפול. רקמות מהמטופלים הללו נאספו לפני שהם קיבלו כימותרפיה ניאו-אדג'ובנטית, ובוצע פרופיל ביטוי גנים (gene expression profiling). החוקרים הצליחו לזהות דפוסים גנטיים (genetic patterns) בכדי לסייע באפיון סרטן שד דלקתי, נוכחות של היפוקסיה, כמו גם חתימות (signatures) המנבאות את הישארותם של תאים ממאירים (persistence of malignant cells) בבלוטות הלימפה לאחר כימותרפיה ניאו-אדג'ובנטית. בניתוח אותה קבוצת מטופלים, Craciunescu ואח’. חקרו ניגודיות דינמית ב-MRI (dynamic contrast-MRI) באופן פרוספקטיבי. הם פיתחו ציון גידול מורפו פיזיולוגי MPTS (morpho-physiological tumour score), שכאשר נמדד לפני הטיפול, הראה הבטחה מצוינת להיות מסוגל לחזות תגובה לכימותרפיה ניאו-אדג'ובנטית ולהיפרתרמיה.
אנליזה רטרוספקטיבית הולנדית (Dutch) של 40 מטופלות, עם סרטן שד מתקדם מקומית (LABC) שטופלו בתרמורדיותרפיה (thermoradiotherapy) דיווחה על שיעור תגובה קלינית מלאה (cCR) של 42% בעבור מטופלות שהן ללא-דלקתיות (non-inflammatory), ושיעור של 25% עבור מטופלות עם סרטן שד דלקתי. רק ל-7 (18%) מהמטופלים הייתה מחלה הניתנת לניתוח מבחינה טכנית. היפרתרמיה ניתנה פעם בשבוע, וטיפולי ההקרנות ניתנו במקטעים של-2 Gy לשד ולבלוטות לימפה אזוריות במינון כולל של 50 Gy, עם מנת חיזוק (boost) של 6 Gy לבלוטות לימפה מוגדלות בצורה גסה (grossly enlarged lymph nodes). השליטה המקומית למשך שלוש השנים עמדה על 46%; המחברים הציעו כי העלאת המינון מעל ל-50-56 Gy המנוצל, עשויה לשפר את שיעור השליטה הזה. לא צוין האם מטופלות כלשהן עברו כריתת שד (mastectomy), או אם משהיא מ-33 המטופלות שהוגדרו כבלתי ניתנות לניתוח לפני הטיפול הורדו בשלבים (downstaged) בכדי לאפשר כריתה כירורגית.
הניסוי האקראי היחיד בפאזה 3, שהעריך היפרתרמיה במטופלים עם סרטן שד מתקדם מקומית ללא סרטן שד בעבר (intact LABC), נערך על ידי המועצה למחקר רפואי (Medical Research Council). תוצאותיו אוחדו על ידי קבוצת ההיפרתרמיה השיתופית הבינלאומית (International Collaborative Hyperthermia Group), לאחר שצבירתם של ארבעה ניסויים מתחרים אחרים הייתה נמוכה מהצפוי; לרוב המוחלט של המטופלות באנליזה המשולבת הזאת הייתה הישנות של סרטן השד בדופן בית החזה. בניסוי של המועצה למחקר רפואי (MRC) היו שתי תת-קבוצות שונות של מטופלים; קבוצה אחת עם הישנות המחלה, וקבוצה אחת עם קרצינומות ראשוניות מתקדמות מקומיות של השד (locally advanced carcinomas of the intact breast), שהאחרונה שבהן הכילה 29 מטופלים בלבד. כל 29 המטופלים סבלו מנגעים בדירוג 3T או 4T, ונחשבו כבלתי ניתנים לניתוח; לא דווח האם המטופלים עברו כריתה כירורגית. 17 מטופלים הוקצו באופן אקראי לטיפול דפיניטיבי בתרמורדיותרפיה (definitive thermoradiotherapy), בעוד שה-12 האחרים קיבלו טיפולי הקרנות בלבד. הקרינה נקבעה במקטעים של 2 Gy למינון כולל של 50 Gy, ולאחר מכן מנת חיזוק (boost) של 15 Gy לגידול הגס (gross tumour); לא ניתן דיווח האם בלוטות הלימפה האזוריות (regional lymphatics) טופלו. היפרתרמיה ניתנה פעם בשבוע, במטרה לשמור על טמפרטורה מינימלית של 43 מעלות צלזיוס למשך 60 דקות, למשך 6 מפגשי טיפול בהיפרתרמיה בסך הכל. בדיקות התרמומטריה (thermometry probe) הוצבו הן לתוך הגידולים והן על פני השטח של גידולים לצורך ניטור הטמפרטורה.
מתוך 17 המטופלים שקיבלו תרמורדיותרפיה (לא דווח על פרטים של 12 מטופלים שקיבלו הקרנות בלבד), כמעט 50% (8/17) התייצגו עם מחלה גרורתית מרוחקת. הם הוקרנו למינון חציוני של 64 Gy (טווח 36-70 Gy) וכל ה-17 קיבלו לפחות שלושה מפגשים של טיפול בהיפרתרמיה; 11 מהם קיבלו את כל ששת הטיפולים המתוכננים. עשרה מתוך 17 (59%) מהמטופלים שקיבלו תרמורדיותרפיה השיגו תגובה קלינית מלאה (cCR), לעומת שמונה מתוך 12 (67%) באלה שטופלו בטיפולי הקרנות בלבד; ההבדלים הללו לא היו מובהקים סטטיסטית.
כאשר הושוו הפרמטרים התרמיים במטופלות עם סרטן שד מתקדם מקומית (LABC) אלה, לבין מטופלות עם הישנות של המחלה באותו הניסוי, נמצאו מספר הבדלים מובהקים סטטיסטית. רוב המדדים התרמיים היו דומים בין שתי הקבוצות (כולל T90 ו-T50), אך ממוצע הזמן (time averaged) של Tmax ,Tmax (פיק) ואחוז החיישנים מעל 43 מעלות צלזיוס (%sensors > 43°C), היו כולם נמוכים יותר אצל המטופלות ללא מחלת סרטן השד בעבר (intact breasts). המחברים הניחו כי ניתן להסביר את חוסר ההתאמות הללו על ידי העובדה שבעוד שלמטופלים עם הישנות של המחלה היו עם אזורי מחלה גדולים יותר (חציון 93 לעומת 44 סמ"ר, p = 0.04), למטופלים עם מחלה ראשונית בשדיים (intact breasts) היו עומקי גידול (tumour depths) גדולים יותר. בנוסף, ייתכן ששיעורי התגובה היו גבוהים יותר מטופלות עם המחלה המתקדמת מקומית, במידה והיה ניתן לתת את ההיפרתרמיה עם אחוז גבוה יותר של החיישנים מעל 43 מעלות צלזיוס (%sensors > 43°C), מכיוון שהמטרה של ההיפרתרמיה בניסוי הייתה לשמר על כל בדיקות התרמומטריה בטמפרטורה של מעל ל-43 מעלות צלזיוס למשך 60 דקות, מה שמצביע על כך שהמטופלות עם סרטן שד לראשונה (intact breasts) לא חוממו בצורה מספקת עם הטכניקה שננקטה.
חלק מהמטופלות עם סרטן שד מתקדם מקומית (LABC) עדיין עוברות טיפול כירורגי מראש, עם ההוספה של היפרתרמיה לטיפול בהקרנות במסגרת האדג'ובנטית לאחר שבוצעה כריתת שד (mastectomy). Welz ואח’. דיווחו על ניתוח רטרוספקטיבי במוסד יחיד של תת-קבוצה של 13 מטופלים, שטופלו בתרמורדיותרפיה במסגרת האדג'ובנטית (adjuvant setting); 10 מהמטופלים הללו קיבלו כימותרפיה ניאו- אדג'ובנטית או אדג'ובנטית (אף אחד לא קיבל טיפול כימותרפיה במקביל). היפרתרמיה נוספה לטיפול בקרינה באוכלוסיית סיכון גבוה זו, עבור שולי רווח של מתחת ל-1 ס"מ עם כריתה מסוג R1 (R1 resection), מחלה בדירוג T3/4, יותר מ-3 בלוטות לימפה חיוביות בבית השחי (axillary lymph nodes) או גידולים בדרגה 2/3. נצפתה רק הישנות מקומית (local recurrence) אחת, ב-31 חודשים לאחר הטיפול (מעקב חציוני של 28 חודשים), עבור שיעור השליטה המקומית האקטוארית (actuarial local control) לשלוש שנים של 75%.
מסקנות
המטרה של הוספת היפרתרמיה לטיפול בקרינה ו/או כימותרפיה היא להגביר את שיעורי התגובה, ובתקווה גם להגברת השליטה מקומית (local control) וההישרדות ללא מחלה (disease-free survival). להיפרתרמיה קיים בסיס תיאורטי חזק, והיא הוכחה כבעלת יתרונות בנסיבות של הישנות של סרטן השד בדופן בית החזה. מכיוון שכימותרפיה טרום ניתוחית הוכחה כמשפרת את התוצאות במסגרת של סרטן שד מתקדם מקומית (LABC), זה נראה אינטואיטיבי להגביר את הטיפול הטרום-ניתוחי על מנת לשפר עוד יותר את התוצאות הללו. הודגם כי התוספת של היפרתרמיה לכימורדיותרפיה טרום-ניתוחית (preoperative chemoradiotherapy) מגבירה את שיעורי התגובה הקלינית המלאה (cCR) ואת שיעורי התגובה הפתולוגית המלאה (pCR) יותר מאשר כימותרפיה בלבד בסדרות מקרים קטנות (small series), והיא דומה לדיווחים מסוימים על טיפול בכימותרפיה במקביל. יש לבצע ניסויים אקראיים שיתופיים אשר בוחנים את השילוב של היפרתרמיה עם כימותרפיה לעומת השילוב של היפרתרמיה עם כימורדיותרפיה או כימורדיותרפיה בלבד, במסגרת הניאו-אדג'ובנטית (neoadjuvant setting) על מנת להבחין האם היפרתרמיה מוסיפה יתרון. היעדר גישה נרחבת למוסדות בעלי ניסיון בביצוע ההיפרתרמיה מהווה מחסום קריטי בפני ניסויים מסוג זה וצריך לקבל התייחסות. מדדים של הפיזיולוגיה של הגידול, בפרט החמצון של הגידול, בין אם באופן פולשני או לא פולשני, עשויים לסייע בבחירה טובה יותר של מטופלים שיכולים להפיק תועלת מהגישות הללו.



