
Re-irradiation and Hyperthermia in Breast Cancer
Clinical oncology, Royal College of Radiologists, Great Britain, Feb 2018; 30:2, 73-84.
O. Kaidar-Person1, S. Oldenborg2, P. Poortmans3.
- Department of Oncology, Radiation Oncology Unit, Rambam Health Care Campus, Haifa, Israel
- Department of Radiation Oncology, Academic Medical Centre, University of Amsterdam, Amsterdam, The Netherlands
- Department of Radiation Oncology, Institute Curie, Paris, France
תקציר
מחצית מההישנות המקומית-אזורית לאחר טיפול בסרטן השד הן מאורעות מבודדים. יש לבצע דירוג מחדש של המחלה על מנת לבחור חולים לטיפול הצלה לריפויי (curative salvage). הגישה תלויה במאפייני הסרטן הראשוני והחוזר, טיפולים מקומיים-אזוריים וסיסטמיים קודמים, אזור ההישנות, תחלואה נלווית ורצונו של המטופל. דיון רב-תחומי צריך להיות מאוגד לתהליך קבלת ההחלטות המשותף. לאור פוטנציאל ההישרדות ארוך-הטווח ללא מחלה, יש להשתמש בתיחום קפדני של נפח המטרה ובבחירת הטכניקות המתאימות ביותר כדי להפחית את הסיכון לרעילות. מטרת סקירה זו הינה לספק לרופאים כלים לניהול התרחישים השונים של חולות סרטן השד עם הישנות מקומית-אזורית בהקשר של הקרנה חוזרת.
הצהרת אסטרטגיות חיפוש בשימוש ומקורות מידע –
משאבים רפואיים מסורתיים שימשו למציאת התוכן של מאמר סקירה זה, כולל נתונים הקשורים לעבודתו של אחד המחברים עצמם (S.O.).
מבוא
ההתקדמות בבדיקות סקר וטיפולים בסרטן השד, כולל הדמיה להנחיית ניתוחים והקרנות, הורידה באופן משמעותי את שיעורי ההישנות המקומית-אזורית (locoregional recurrence) ל5 ו-10 שנים, בעוד שההישרדות הכוללת גדלה. הישרדות ממושכת מגדילה את הסיכויים להישנות מקומית-אזורית ו/או סרטן שד איפסילטרלי שני, אשר מכתיבה את הצורך בטיפול חוזר, כולל הקרנות חוזרות. לשם כך, הבנת העקרונות הבסיסיים של הקרנות חוזרות הכרחי לניהול של חולים אלה, במיוחד כאשר כמחצית מחולים עם הישנות של סרטן השד המתייצגים עם הישנות מקומית אזורית מבודדת והישרדות פוטנציאלית לטווח ארוך. סקירה זו נועדה לספק לקלינאים כלים לניהול התרחישים השונים של הישנות מקומית אזורית, עם המגבלה שחלק גדול מהנתונים שפורסמו בנוגע להקרנות חוזרות הגיעו ממחקרים בבעלי חיים, קבוצות רטרוספקטיביות ומחקרים פרוספקטיביים קטנים, עם נתונים קצובים בלבד מניסויים רב-מרכזיים פרוספקטיביים.
עקרונות כלליים ואתגרים של הקרנה חוזרת ומינון מצטבר מקסימלי בסרטן השד
במקרה של הקרנות (הקרנות חוזרות) בסרטן השד, המבנים העיקריים שיש להתייחס אליהם כאיברים בסיכון הם העור, השכבה התת עורית ואגני הלימפה (lymphatic basins), הלב, הריאות, כלוב הצלעות והמקלעת הברכיאלית. בהתאם לנפח וטכניקות טיפול ההקרנות, יש לשקול איברים אחרים, כגון כבד ובלוטות התריס. עבור רקמות עם פרוליפרציה מהירה כמו העור, ההנחה היא שיכולת הרקמה לשאת הקרנה חוזרת, תלויה בתגובה לנזקי קרינה על ידי אכלוס מחדש ונדידה כדי לשחזר את אוכלוסיית התאים ולהחזיר את שלמות הרקמה. במחקרים פרה-קליניים, הקרנה חוזרת במינונים הקרובים למינון הראשוני המלא שנסבל, נמצאה אפשרית לאחר מספר חודשים מהטיפול הראשוני אם הייתה החלמה נראית לעין של העור לפני קורס ההקרנות השני. הקרנה מחדש של אזורי בלוטות הלימפה בבית השחי בעלת פוטנציאל לגרום לפגיעה במקלעת הברכיאלית. הן רקמת הלימפה והן המקלעת הברכיאלית הינן רקמות העוברות פרוליפרציה איטית עם סיכון גבוה יותר לנזק תת-קליני שיורי. לכן, במידת האפשר, יש להימנע מהקרנה חוזרת לנפחים אלה, שכן היא עלולה לגרום לתחלואה משמעותית בלימפאדמה, תפקוד לקוי של הכתף ונזק נוירולוגי. הקרנה של כלוב הצלעות יכולה להיות קשורה לנזק לעצמות. העצם מוערכת כבעלת יחס α/β של 1.8-2.8 Gy, מה שמעיד על כך שהעצם מתנהגת כמו רקמה המגיבה מאוחר. סיבוך זה יכול לגרום לשבריריות העצם (למשל, שבר צלעות ספונטני או לאחר טראומה מינימלית) בעקבות אוסטאופורוזיס או נמק. גורמים נוספים שיכולים להוסיף לסיבוכים הקשורים לעצמות בחולי סרטן השד כוללים את המנופאוזה, טיפולים סיסטמיים כולל מעכבי ארומטאז (aromatase), אוסטאופורוזיס וטיפול ממושך בביספוספונטים (Bisphosphonate). מחקר שנערך לאחרונה דיווח על שיעור של 7% לאחר 5 שנים של שברים בצלעות בחולי סרטן השד שטופלו בהקרנות חוזרת והיפרתרמיה. רוב השברים התרחשו באזור ההצטלבות של הפוטון/אלקטרון, מה שמרמז על מינונים גבוהים כתוצאה מחפיפת שדה (אזור של עד 40% מנת יתר). המוקד המרבי האפשרי EQD2 (מינון שווה ערך לפרקציה של 2 Gy) עם מנת יתר של 40% המחושב עבור 8×4 Gy הוא 87 Gy, שהוא גבוה יותר ב74% מאשר TD 5/5 (מינון סבילות עם 5% סיבוכים ב5 שנים). גורמים אחרים שנמצאו כמנבאים משמעותיים לשברים בצלעות היו מינון גבוה לפרקציה ונפחי הקרנות גדולים, בעוד שהגדלת מספר טיפולי ההיפרתרמיה לא נמצאה כמגבירה את הסיכון לשבר בצלעות.
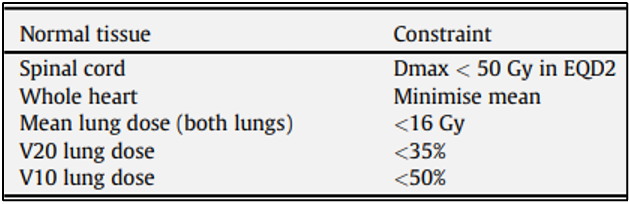
ישנם פחות נתונים לגבי עמידות הלב ו/או הריאות להקרנות חוזרות, ככל הנראה הודות לטיפול המופעל בהימנעות ממינונים מופרזים למבנים אלה, שכן הסיכון למחלות לב וסיבוכים ריאתיים מהקרנות מוכר היטב. טבלאות 1 ו-2 מפרטות את מגבלות הרקמה הנורמלית בשני ניסוים פרוספקטיביים שלב II להקרנות חוזרות בסרטן השד. ההבדלים ממחישים את חוסר ההסכמה בנוגע להגבלת המינון ברקמה תקינה, במקרה של הקרנה מחדש של דופן בית החזה או השד. לכן, בייחוד במקרים של הקרנה מחדש, מאמצים צריכים להיעשות בכדי להפחית את הנפחים המוקרנים ואת המינונים לרקמות נורמליות.
המנה/פרקציה בהקרנות חוזרת, המינון המצטבר של הקרנות ושיעורי הרעילות במחקרים השונים של הקרנה חוזרת מפורטים בטבלה 3. המינון המצטבר של טיפול ההקרנות במחקרים אלה נע בין פחות מ-80 Gy ליותר מ-130 Gy ללא רעילות משמעותית שדווחה. עם זאת, ערכים אלה נלקחו מסדרות קטנות, תוך שימוש בלוחות זמנים שונים של הקרנות, נפחים וטכניקות, ועם מידע מועט בנוגע רעילות. יתר על כן, מחקרים אלה אינם מספקים הערכה ברורה של המינון האופטימלי בהקרנות חוזרות ביחס לתוצאות של מחלה נתונה. היקף המחלה (למשל, מקרוסקופי לעומת מיקרוסקופי; הישנות ראשונה/שנייה או פליאציה למחלה גרורתית) והמרווח בין שני קורסי הקרינה השתנו באופן משמעותי בתוך מחזור אחד ובין מחקרים. לגורמים אלה יש השפעה משמעותית על שיעורי הבקרה המקומיים, ללא קשר למתן טיפול במקביל.
לכן, החוקרים ממליצים כי במקרה של הקרנה חוזרת, יש ליישם את העיקרון הכללי של טיפול הקרנתי, תוך שתי דאגות עיקריות: האפשרות של עמידות לקרינה (במיוחד עבור הישנות מוקדמת) והאפשרות לסבילות מופחתת ברקמות תקינות:
- הערכה מלאה של קורס ההקרנה הקודם, המנחה את תכנון הטיפול הבא.
< >התועלת הקלינית הצפויה של הקרנה חוזרת צריכה להתעלות על הרעילות הפוטנציאלית. הערכה זהירה של גורמים פוטנציאליים אחרים לסבילות ירודה להקרנה (חוזרת), כגון גורמים הקשורים למטופל (תחלואה נלווית, סטטוס תפקודי) וגורמים הקשורים לטיפול (טיפול סיסטמי).יש לעשות מאמצים על מנת להפחית את הנפחים והמינונים המוקרנים לרקמות רגילות; לרבות ויתור על הקרנות אלקטיביות, שימוש בניתוח כריתה (debulking surgery) ושימוש ברדיוסנסיטייזרים, כגון כימותרפיה ו/או היפרתרמיה.Radiation Therapy Oncology Group (RTOG) על קרינה חיצונית עם מאיץ קווי בתכנון קרינה תלת ממדית (D3) בהקרנה חלקית חוזרת לשד.
להלן טבלה 1: מאפייני החולים, הגידולים והטיפול.
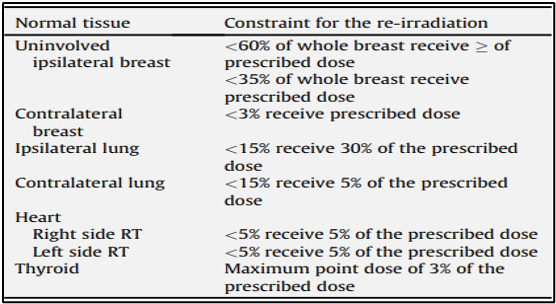
להלן טבלה 2: הגבלות מנה נוכחיות ברקמה תקינה שאומצו מניסוי שלב 2 NL31630. 018.10 עבור הקרנה חוזרת של קיר בית החזה או השד בשילוב עם היפרתרמיה, עם או ללא כימותרפיה.
Second Breast-conserving Therapy and Reirradiation
הגישה הטיפולית הסטנדרטית של הישנות שד איפסילטרלי לאחר טיפול משמר שד (BCT; כלומר, כריתת שד חלקית (lumpectomy) וקרינה) היא כריתת שד מלאה (mastectomy), עם שיעורי הישנות שנייה לאחר כריתת שד מלאה (salvage mastectomy) של כ-10%. במקרים נבחרים, במיוחד התפרצות מאוחרת של הישנות שד מוגבלת (כולל ראשוניות שנייה) או במטופלות המסרבות לכריתת שד מלאה, ניתן לשקול ניתוח משמר שד שני עם או ללא הקרנה חוזרת ו/או טיפול סיסטמי.
עתה, הניסוי הרב-מרכזי הגדול ביותר המעריך גישת טיפול שני משמר שד (BCT) נערך על ידי קבוצת העבודה לסרטן השד GEC-ESTRO. מאתיים ושבע-עשרה מטופלות עברו טיפול הצלה משמר שד עם טיפול קרינתי מואץ חלקי של השד באמצעות ברכיתרפיה אינטרסטיציאלית. במעקב חציוני של 3.9 שנים, שיעורי הבקרה המקומית היו מעודדים, עם שיעורי הישנות מקומית-אזורית אקטואריים של 5 ו-10 שנים של 5.6% ו-7.2%, בהתאמה. שיעורי גרורות מרוחקות היו 9.6% ו-19.1% ושיעורי ההישרדות הכוללים היו 88.7% ו-76.4%, בהתאמה. בניתוח רב-משתנים, הציון ההיסטולוגי היה גורם מנבא להישנות מקומית שנייה (P =0.008) ולהישרדות הכוללת (P =0.02), בעוד שגודל הגידול היה גורם מנבא עבור גרורות מרוחקות (P= 0.03). שיעור הסיבוכים בדרגה 3-4 היה 11% ותוצאה קוסמטית מצוינת עד טובה הושגה ב-85% מהחולים. תוצאות אלה יכולות להיחשב כמקבילות לפחות לאלה שהושגו על ידי כריתת הצלה מלאה של השד (salvage mastectomy). עם זאת, בחירה זהירה של חולים וניסיון בשימוש בברכיתרפיה אינטרסטיציאלית מבוססת צנתר היא תנאי מקדים לתוצאות מוצלחות כאלה. התוצאות הראשוניות של ניסוי שלב 2 RTOG 1014 המתמשך, של ניסוי על קרינה חיצונית עם מאיץ קווי בתכנון קרינה תלת ממדית (D3) בהקרנה חלקית חוזרת לשד (three-dimensional external beam partial breast reirradiation), מראות שיעור רעילות מאוחרת בדרגה 3 של 6.9%, מה שמרמז על כך שקרינה חיצונית תלת-ממדית במאיץ קווי עשויה להתאים גם היא בהגדרה זו. לכן, מטופלות שיש להן רצון מפורש לשימור השד יכולות לעבור ניתוח הצלה משמר חזה ולאחריו הקרנה מחדש (איור 1).
טבלה 4 מסכמת מחקרים המעריכים הקרנה חוזרת במסגרת של טיפול משמר שד שני. שיעורי הבקרה המקומית ל-5 שנים שדווחו במחקרים אלה נעו בין 69% ל-96% עם תוצאות קוסמטיות טובות אצל רוב המטופלים. חשוב לציין שאף אחד מהמחקרים הללו לא כלל מטופלות עם מחלה מקרוסקופית לאחר ניתוח שני לשימור השד והמחקרים היו שונים בכל הנוגע לטיפולים סיסטמיים. מטופלות שענו על כל הדרישות הבאות עשויות לקבל טיפול שני משמר שד (Second Breast-conserving Therapy):
- סרטן שד בסיכון נמוך (באופן אידיאלי קולטן-הורמון חיובי / HER2-שלילי; לא דרגה 3; לא לובולרי; אין מרכיב אינטרה-דוקטלי נרחב).
- צפויה תוצאה קוסמטית טובה לאחר הניתוח השני בהתבסס על יחס גידול/גודל חזה חיובי ומיקום הגידול בתוך השד.
- השפעות מאוחרות מוגבלות או נעדרות לאחר ההקרנות הראשוניות.
- צוות רב תחומי מנוסה.
- הסכמה מדעת.
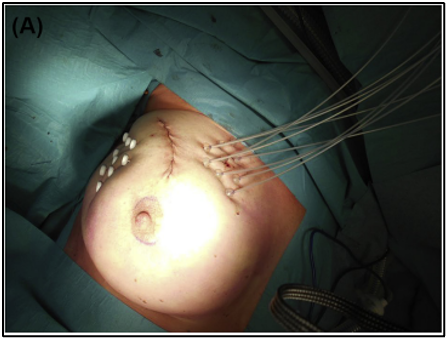
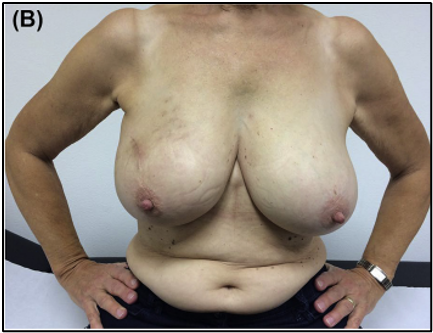
A 68-year-old patient at the end surgery and positioning of the brachytherapy catheters (A) and 7 weeks after brachytherapy (B).
להלן טבלה 4: Re-irradiation after second breast-conserving therapy
הקרנה חוזרת (Re-irradiation) של דופן בית החזה והישנות מקומית מתקדמת שאינה ניתנת לניתוח
הטיפול בהישנות דופן בית החזה לאחר כריתת שד ראשונית (primary mastectomy) הוא כריתה כירורגית. כריתה לבדה לעתים קרובות אינה מספקת שליטה מקומית מתמשכת, עם שיעורי כשל מקומיים מדווחים של עד 70% לאחר הניתוח. לכן, הקרנות נכללות באופן שגרתי במקרה של טיפול הצלה עם כוונה מרפאת ללא הקרנות לאחר-כריתת שד שבוצעו לפני כן, ויש לשקול אותם עבור חולים שעברו הקרנות לאחר כריתת שד בהתייצגות הראשונית של המחלה, במיוחד עבור חולים עם הישנות דופן בית החזה מבודדת ואף יותר במקרה של שוליים חיוביים לאחר כריתת שד הצלה (salvage mastectomy). הקרנה חוזרת יכולה להינתן לבד או בשילוב עם כימותרפיה ו/או היפרתרמיה בו זמנית בהתאם להיקף המחלה.
משטרי טיפול הכימותרפיה שניתנים במקביל להקרנות חוזרות לא תוארו היטב במחקרים הרטרוספקטיביים. החומרים הציטוטוקסיים הנפוצים היו 5-fluorouracilbased, טקסנים, vinorelbine ,gemcitabine, cisplatin וdoxorubicin ליפוזומאלי. מעט מאוד דווח על trastuzumab, שכן רוב המחקרים היו לפני אישורו. כ-7% מהחולים עם הישנות איפסילטרלית מתייצגים עם מחלה מקומית מתקדמת ו/או דלקתית שאינה ניתנת לכריתה. הקרנה חוזרת, מוטב בשילוב עם טיפול סיסטמי ו/או היפרתרמיה, צריכה להיחשב כשיטת הטיפול העיקרית בחולים אלה. תפקיד הקרנות חוזרות בלבד (ללא כימותרפיה או היפרתרמיה) למחלה שאינה ניתנת לניתוח אינו מוכח היטב, שכן החולים שנכללו במחקרים לעתים קרובות טופלו במקביל בכימותרפיה או בהיפרתרמיה.
הנתונים עבור מתן כימותרפיה במקביל אינם חד-משמעיים, שכן זה היה בשימוש לעתים קרובות יותר עבור חולים עם מחלה יותר מתקדמת. עם זאת, נתונים ממחקרים שהעריכו מתן כימותרפיה במקביל כטיפול טרום ניתוחי בחולים עם מחלה מקומית מתקדמת שאינה ניתחה במסגרת קו ראשון, מצביעים על כך שתוספת של כימותרפיה מגדילה את שיעורי התגובה, כולל תגובות מלאות. שיעורי התגובה המלאה לאחר הקרנה חוזרת וכימותרפיה הן למחלה מיקרוסקופית והן למחלה רזידואלית מקרוסקופית היו כ-44%. ישנם נתונים תומכים שבשילוב עם היפרתרמיה, שיעורי התגובה המלאה עולים עד 70%.
טיפול סיסטמי לאחר טיפול מקומי
חולים עם הישנות מקומית-אזורית מבודדת שעברו ניתוח עם קרינה הינם מועמדים לטיפול סיסטמי נוסף. ניסוי אקראי פרוספקטיבי (CALOR), שכלל 162 חולים, העריך את תפקיד הכימותרפיה לאחר השלמת הטיפול המקומי. חולים בזרוע המחקר של הכימותרפיה שטופלו בזמן האבחון הראשוני עם ציקלופוספאמיד (cyclophosphamide), מטוטרקסט (methotrexate), 5-fluorouracil-based או ללא כימותרפיה אדג'ובנטית קודמת, קיבלו משטרי טיפול מבוססי אנתרה-ציקלינים (anthracycline-based) בזמן ההישנות. חולים שטופלו לפני כן באנתרה-ציקלינים, קיבלו טקסנים (taxanes) בזמן ההישנות וחולים שטופלו בטקסנים כקו ראשון טופלו בקפצטבין (capecitabine). ההישרדות ללא מחלה במשך 5 שנים השתפרה עם כימותרפיה (69% לעומת 57%; P = 0.046), במיוחד במקרה של הישנות אצל נשים בעלות קולטני אסטרוגן שליליים (בעיקר קולטן פרוגסטרון שלילי), אך על חשבון של 15% תופעות לוואי חמורות. בניסוי זה, רק 19% מהחולים טופלו בהקרנות חוזרות. תוצאות אלה, בשילוב עם נתונים מטיפול סיסטמי אדג'ובנטי במסגרת קו-ראשון, מצביעות על כך שיש לשקול מתן טיפול סיסטמי בחולים עם הישנות מקומית-אזורית מבודדת, שכן כשל מרוחק או התקדמות של מחלה מערכתית נותרה הסיבה העיקרית לתמותה בחולים עם סרטן השד.
בשל היעדר נתונים, החוקרים ממליצים לדון ברצף הטיפולים המערכתיים והמקומיים על בסיס כל מקרה, תוך התחשבות במשמעות היחסית של הסיכונים המקומיים-אזוריים והמערכתיים להתקדמות המחלה.
הרציונל בהיפרתרמיה
קיים רציונל ביולוגי וקליני חזק ליישום היפרתרמיה כשיטת טיפול אונקולוגית בנוסף להקרנות ו/או טיפול סיסטמי, במיוחד במקרים של הקרנות חוזרות. טמפרטורות מקומיות של 41-45 מעלות צלזיוס המושגות עם היפרתרמיה גורמות לדנטורציה של חלבונים המובילה ציטוטוקסיות. תהליך זה מוגבל ומתרחש בעיקר בתאים היפוקסיים, חומציים וחסרי חומרים מזינים, בהתאם לגידול, שם כימותרפיה והקרנות יעילות פחות. לעומת זאת, רקמה רגילה אינה מושפעת מכיוון שהיא מוגנת על ידי פרפוזיה דרך מבנים מאורגנים של כלי-הדם. ההשפעה של היפרתרמיה מוגבלת מכדי לשמש כגישת טיפול בודדת, אך הוכחה כמגבירה את ההשפעות התרפויטית של הקרנות וכימותרפיה.
ההשפעה הסינרגטית עם הקרנות ו/או כימותרפיה מיוחסת להפרעה במנגנוני תיקון הדנ"א (עקב דנטורציה של חלבונים) ולהגברת הפרפוזיה (כלומר, חמצון מחדש והעברת תרופות) לגידול.
על ידי שיפור ההשפעה של הקרנות ו/או כימותרפיה, ניתן להשתמש במינונים נמוכים יותר של טיפולים אלה כדי להשיג את אותה השפעה ציטוטוקסית. לפיכך, זה יכול להפחית את תופעות הלוואי הפוטנציאליות של טיפול מחדש. לדוגמה, כדי לכמת את הרגישות לקרינה על ידי היפרתרמיה, פרמטר שיעור השיפור התרמי (TER- thermal enhancement ratio) הוגדר כיחס בין מנת הקרינה לרדיותרפיה בלבד חלקי מנת הקרינה לרדיותרפיה והיפרתרמיה על מנת להגיע לשוויון בהישרדות תאים במבחנה (in vitro). פרמטר שיעור השיפור התרמי (TER) נע בין 1.5 ל-2.5 לגידול ובין 1 ל-2.5 לעור, בהתאם לטמפרטורה המוחלטת, משך החימום, רצף ומרווח הזמן בין הקרנות והיפרתרמיה וההיסטולוגיה של הגידול. מרווח הזמן האופטימלי בין הקרנות להיפרתרמיה קצר מ-4 שעות. למרות ששיעור השיפור התרמי (TER) המקסימלי מושג תוך מתן מקביל של הקרנות והיפרתרמיה, יש להימנע מכך בפרקטיקה הקלינית מכיוון שבמצב זה קיימת השפעה באותה המידה הן על הגידול והן על רקמות נורמליות.
היעילות של היפרתרמיה בשילוב עם הקרנות ו/או טיפול סיסטמי, אוששה על ידי מספר ניסויים אקראיים שלב I-III על מלנומה, סרטן צוואר הרחם, השד והראש והצוואר. הטיפול המערכתי בגידולים שונים כלל בתוכו תרכובות פלטינום (platin derivates), מיטומיצין C (mitomycin) ומשילוב של אטופוסיד (etoposide), איפוספאמיד (ifosfamide) ודוקסורוביצין (doxorubicin). ממצאים אחרונים מצביעים על כך ששילוב במבחנה (in vitro) של ציספלטין, היפרתרמיה ומעכבי PARP1 הדגימו כי ניתן להשתמש בריכוז ציספלטין נמוך פי 10, תוך השגת השפעות ציטוטוקסיות דומות. הניסויים בוצעו תוך שימוש במודל רקומבינציה הומולוגית (homologous recombination proficient) בשורות תאים של קרצינומה של צוואר הרחם (R1, SiHa, HeLa), ובמודל רקומבינציה הומולוגית של חולדה עם שתל של רבדומיוסרקומה (rhabdomyosarcoma allograft).
הנחיות אבטחת איכות בינלאומיות קיימות הן ליישום היפרתרמיה והן לדרישות הטכניות של מכשירי החימום. מספר טכניקות מיושמות בהיפרתרמיה קלינית, כתלות בנפח הגידול ומיקומו, המשתנה מהיפרתרמיה מקומית להיפרתרמיה כלל-גופית. רוב הציוד משתמש בחימום אלקטרומגנטי בטווח גלי-הרדיו או גלי-מיקרו (≤2450 MHz). התדירות של יישום ההיפרתרמיה, תלויה במיקום הגידול ובטכניקת החימום. עומק החדירה של השדה האלקטרומגנטי פוחת עם התגברות התדירות. היפרתרמיה מקומית (Local), המכונה גם היפרתרמיה שטחית (superficial), מיושמת על נפחי מטרה הממוקמים באופן שטחי ולכן מיושמת באופן נפוץ לטיפול בהישנות דופן בית החזה (איור 2).
A 68-year-old patient at the end surgery and positioning of the brachytherapy catheters (A) and 7 weeks after brachytherapy (B).
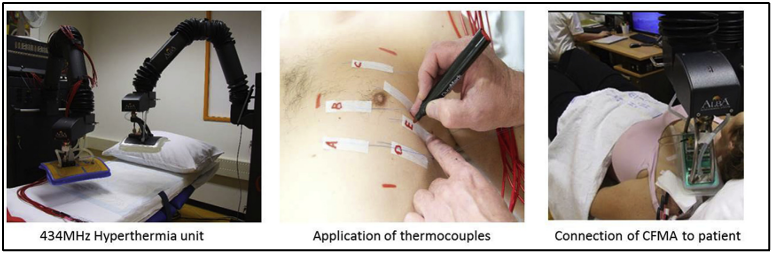
היפרתרמיה והקרנות חוזרות (Re-irradiation) בסרטן השד
בחולות סרטן שד עם הישנות מקומית-אזורית שאינה ניתנת לניתוח, באזור שהוקרן בעבר, יש לשקול עבורן הקרנה חוזרת והיפרתרמיה (איור 3). תוצאות משולבות של חמישה ניסויי שלב III, הדגימו עלייה של 26% בשיעורי התגובה המלאה ושיפור של 20% בשיעור השליטה המקומית למשך 3 שנים, כאשר היפרתרמיה נוספה להקרנות בהישנות מקומית-אזורית בקרב חולות סרטן השד, באזורים שהוקרנו בעבר. מטא-אנליזה של Datta ואח'., אישרה את התוצאות הללו. ב-16 מחקרים (779 מטופלים ממחקרים זרוע אחת ו-83 מטופלים ממחקרים של 2 זרועות), התגובה המלאה השתפרה מ-38% להקרנה חוזרת בלבד ל-66.6% להקרנה חוזרת עם היפרתרמיה. מנת הקרנה ממוצעת של 36.7 Gy (טווח 29.4-50.5 Gy) ניתנה במנה ממוצעת לפרקציה של 2.7 Gy (2-4 Gy). לא ניתן היה לחשב את פרופיל הרעילות של חולים אלה, מכיוון שרעילות אקוטית ומאוחרת לא דווחה באופן עקבי בעבור תת-הקבוצות של החולים וקריטריוני הניקוד היו הטרוגניים למדי. למרות זאת, אף אחד מהמחקרים לא דיווח על שום עלייה משמעותית ברעילות עם הוספה של היפרתרמיה להקרנה חוזרת. זיהוי תת-קבוצה מועדפת של מטופלים היה בלתי אפשרי מכיוון שגורמים פרוגנוסטיים חשובים דווחו בצורה לא טובה. אף אחד מהפרמטרים הקשורים לטיפול לא נמצא כמשפיע על התוצאות (הן אונקולוגיות והן רעילות). עם זאת, העניין עשוי להיות מוסבר על ידי אוכלוסיית המטופלים הלא הומוגנית במחקרים אלה. לדוגמה, במחקר של Wahl ואח'., היפרתרמיה העלתה את שיעור התגובה המלאה מ-39% בחולים ללא היפרתרמיה ל-67% בחולים עם היפרתרמיה (P > 0.08). אף אחד ממשתני הטיפול שנבדקו לא נמצא כמשפיעים על תוצאות הטיפול, אך המחקר כלל חולים עם ובלי מחלה מקרוסקופית, שככל הנראה מיסכה את אפקט משתני הטיפול.
שני מחקרים מרכזיים נוספים שלא נכללו בסקירה של Datta, יכולים לסייע בבחירה טובה יותר של מטופלים ובפרוטוקולי טיפול טובים יותר. במחקר הראשון, 414 חולות עם הישנות סרטן שד שאינו ניתן לניתוח אשר טופלו רבות לפני, קיבלו הקרנה חוזרת והיפרתרמיה עם או בלי טיפול סיסטמי, מתוכן 301 חולות טופלו ב-8 ×4 Gy, פעמיים בשבוע, ו-113 חולות קיבלו 12 ×3 Gy, ארבע פעמים בשבוע. בסך הכל, שיעור התגובה הקלינית (על פי קריטריונים של RECIST: תגובה מלאה + תגובה חלקית) היה 86%. שיעור השליטה המקומית ל-3 שנים היה 25%, עם שיעור הישרדות כולל של 37%. על פי CTCAE v.3 רעילות אקוטית ≥ דרגה 3, אירעה ב-24% מהחולים. הסיכון האקטוארי לרעילות מאוחרת ≥ דרגה 3 היה 23% לאחר 3 שנים. באנליזה רבת-משתנים, משך השליטה המקומית הושפע לרעה מנוכחות הישנות מקומית קודמת, מנוכחות של גרורות מרוחקות, מידות גדולות יותר של הגידול (≥ 10 ס"מ) ומרווח זמן קצר יותר עד להישנות המחלה. אזור ההישנות גם כן השפיע על התוצאה: לחולים עם מחלה אזורית הייתה תוצאה גרועה יותר בהשוואה לחולים עם מחלה מקומית (יחס סיכון 1.8, P=0.003). הסיכון להישנות היה גבוה פי 1.8 עבור מטופלות עם הישנות בתוך השד בהשוואה לחולות עם הישנות בדופן בית החזה (P = 0.022). הסיבה לכך היא ככל הנראה קיומם של גורמים פרוגנוסטיים רעים נוספים בקבוצת החולים עם הישנות בשד, כגון: סרטן שד מקומי מתקדם באבחון ראשוני, הישנות קונטרלטרלית או גודל הישנות גדול. בנוסף, בהישנות השד קיים יותר קושי להגיע עם היפרתרמיה ולחמם בצורה הומוגנית בשל מגבלות טכניות.
פרמטרים של הקרנה חוזרת לא השפיעו על השליטה המקומית ועל רעילות אקוטית, אך כן השפיעו על הסיכון לרעילות מאוחרת למשך 3 שנים. סיכון זה היה 32.7% לאחר 8× 4 Gy ו-16.3% לאחר 12× 3 Gy (P = 0.023). לוח הזמנים של 8 ×4 Gy שולב לעתים קרובות עם שימוש בשדות גדולים וסמוכים של פוטון/אלקטרון, מה שהופך את הערכת התרומה האינדיבידואלית של פרמטרי הקרינה לבלתי אפשרית. מדדים לגבי המינון התרמי שהושג לא היו קשורים לתוצאות הטיפול או לרעילות.
המחקר השני העריך מאורעות של שברים בצלעות בחולים לאחר כריתה מקרוסקופית מלאה של הישנות מקומית-אזורית. לאחר הכריתה, 152 חולים הוקרנו עם 8 ×4 Gy, פעמיים בשבוע, באמצעות שדות פוטון ואלקטרונים סמוכים, 118 חולים הוקרנו עם 12× 3 Gy, ארבע פעמים בשבוע, באמצעות שילוב אחד או שילובים מתחלפים של שדות אלקטרונים גובלים, ולאחר מכן היפרתרמיה פעם או פעמיים בשבוע. מכיוון שלחולים אלה היה עומס גידול נמוך יותר מאשר לקבוצה הראשונה, שיעורי הבקרה האזורית ושיעור הישרדות של 5 שנים היו גבוהים יותר, 70% ו-60%, בהתאמה.
להלן איור 3:
Example of two patients treated for recurrent breast cancer 'en cuirasse’ with a clinical complete response after re-irradiation and hyperthermia.
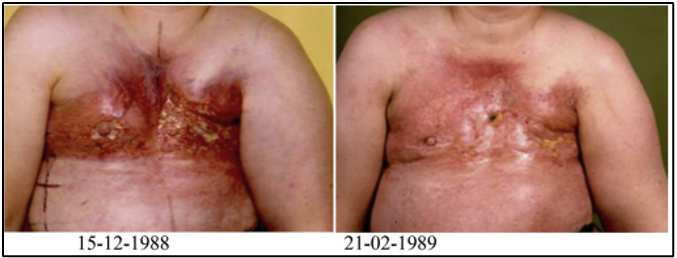
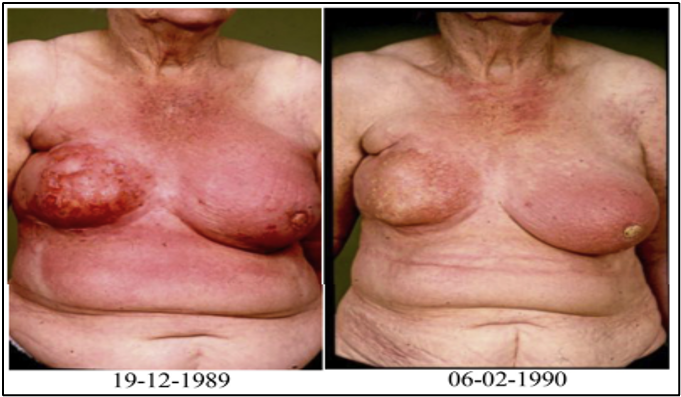
מסקנות
למרות שלחולים עם הישנות מקומית-אזורית יש סיכון גבוה לגרורות מרוחקות במקביל ובעקבות ההישנות, רבים מהם סובלים ממחלה מקומית-אזורית מבודדת ויכולים להיות בעלי הישרדות ללא מחלה ממושכת ואף להחלים לאחר טיפול הצלה (salvage). לכן, יש להעריך את כל החולים עם הישנות מקומית-אזורית לאחר כריתת שד מלאה (mastectomy) או טיפול משמר שד (BCT), לטיפול הצלה אפשרי עם כוונה קורטיבית. בנוכחות מחלה מפושטת, טיפול מקומי עשוי לספק פליאציה יעילה. יש לנקוט אמצעים על מנת למנוע רעילות אפשרית על ידי הימנעות ממינוני קרינה מקומית מצטברים מוגזמים ו/או חפיפה של צמתי שדה, תוכניות היפופרקציונציה קיצוניות והקרנה חוזרת של איברים בסיכון כגון מקלעת ברכיאלית או לימפה.
חולים עם הישנות מקומית אזורית מייצגים קבוצה הטרוגנית. גורמים בעלי ערך ניבוי שלילי לבקרה מתמשכת לאחר הנסיגה מכלילים את גודל הגידול, מיקום הגידול, הישנות מקומית קודמת, גרורות מרוחקות, מחלה אזורית ומרווח זמן קצר יותר עד להישנות המחלה. טיפול ההצלה (Salvage treatment) תלוי בגורמים אלה, בטיפול הראשוני ובגורמים הקשורים למטופל. באופן כללי, זה דורש מודליות של טיפול משולב, אשר צריך להיות מותאם למקרה של הפרט, תוך התחשבות במומחיות של המרכז, עם הפניה למרכזי התייחסות אם רלוונטי (למשל, ברכיתרפיה אינטרסטיציאלית, היפרתרמיה). בנוסף לניתוח ולטיפול בקרינה, יש לשקול טיפול סיסטמי כדי לשפר עוד יותר את שיעורי בקרת המחלה המקומיים והרחוקים.
בסך הכל, כותבי מאמר זה מסיקים כי ניתן להשיג שיעורים טובים של שליטה מקומית עם הקרנה חוזרת, עם שיעור בקרה מקומי של עד 70% למשך 5 שנים בחולים שטופלו בגישות מודאליות משולבות. כדי לשפר את משך השליטה המקומית, מינון מצטבר גבוה יותר צריך להתקבל על ידי מינון קרינה יעיל יותר או העלאת יעילות המינון על-ידי רדיוסנסיטייזרים כמו היפרתרמיה. במדינות מסוימות, כולל הולנד, היפרתרמיה היא חלק מהפרוטוקול הסטנדרטי המשולבת עם הקרנה חוזרת לאחר ניתוח R0/R1 ועבור חולים עם מחלה שאינה ניתנת לניתוח. על אף זאת, שהיפרתרמיה הוכיחה את ערכה במחקרים פרה-קליניים וקליניים מבלי להוסיף רעילות משמעותית, היא עדיין לא בשימוש נרחב.



