
Radiotherapy and hyperthermia for breast cancer patients at high risk of recurrence
International Journal of Hyperthermia, 2022 July, vol.39:1,1010-1016.
Chiara De-Colle1, Anna Beller1, Cihan Gani1, Nicola Weidner1, Vanessa Heinrich1, Ulf Lamprecht1, Stephan Gaupp1, Otilia Voigt1, Oliver Dohm1, Daniel Zips1,2 and Arndt-Christian Müller1,3
- Department of Radiation Oncology, University Hospital and Medical Faculty Tübingen, Eberhard Karls University Tübingen, Tübingen, Germany
- German Cancer Research Center (DKFZ), Heidelberg and German Cancer Consortium (DKTK) Partner Site Tübingen, Tübingen, Germany
- Clinic of Radiation Oncology, Ludwisburg Hospital, Ludwisburg, Germany
תקציר
מטרת המחקר– להעריך את היעילות ארוכת הטווח של שילוב טיפולי הקרנות (radiotherapy) עם היפרתרמיה (hyperthermia), בקבוצה חד-מוסדית גדולה של חולות סרטן השד (breast cancer) שסבלו מהישנות של הגידול, שאובחן לאחרונה, שאינו ניתן לכריתה, או בסיכון גבוה.
חומרים ושיטות – רשומות של חולי סרטן השד (BC) שטופלו בטיפולי הקרנות בשילוב עם היפרתרמיה (RT+HT) בין השנים 1995 ל-2018 נותחו באופן רטרוספקטיבי. רדיותרפיה במינונים של 50-70 Gy ניתנה במקביל להיפרתרמיה שטחית (superficial HT) פעמיים בשבוע. בעבור היפרתרמיה (HT), טמפרטורה בין 41 ל-42 מעלות צלזיוס יושמה למשך כשעה אחת. נקודת התוצא העיקרית (Primary endpoint) הייתה בקרה מקומית (local control), נקודות תוצא משניות כללו רעילות, הישרדות כוללת (overall survival) והישרדות ללא התקדמות (progression-free survival).
תוצאות – בסך הכל נעשתה אנליזה ל191 מטופלים ול-196 טיפולי הקרנות בשילוב עם היפרתרמיה (RT+HT). ב-154 מקרים (78.6%), ניתנו טיפולי הקרנות בשילוב עם היפרתרמיה (RT+HT) בעבור מטופלות עם הישנות של סרטן השד (BC). מבין אלה, 93 (47.4% מהקבוצה כולה) קיבלו רדיותרפיה לפני טיפולי הקרנות בשילוב עם היפרתרמיה (RT+HT). המעקב החציוני עמד על 12.7 שנים. השליטה מקומית (LC) לאחר שנתיים, 5 ו-10 שנים הייתה, 76.4%, 72.8% ו-69.5%, בהתאמה. ההישרדות הכוללת (OS) לאחר שנתיים, 5 ו-10 שנים הייתה 73.5%, 52.3%, ו-35.5%, בהתאמה. הישרדות ללא התקדמות (PFS), לאחר שנתיים, 5 ו-10 שנים הייתה 55.6%, 41% ו-33.6%, בהתאמה. הגורמים המנבאים לשליטה מקומית (LC) היו שלב הגידול, גרורות מרוחקות, ביטוי קולטן אסטרוגן/פרוגסטרון (estrogen/progesterone receptor expression), סטטוס הכריתה ומספר מקטעי (fractions) ההיפרתרמיה (HT). בניתוח רב-משתני (multivariate) הגידול, השלב והביטוי של הקולטן היו משמעותיים. לא נצפו רעילויות אקוטיות או מאוחרות הגבוהות מדרגה 3.
מסקנה– טיפולי הקרנות בשילוב עם היפרתרמיה (RT+HT) מציעים שיעורים גבוהים בשליטה המקומית (LC) לטווח הארוך עם רעילות קונבנציונלית עבור מטופלים עם הישנות של סרטן השד (BC), שאובחן לאחרונה כאינו ניתן לכריתה, או סרטן השד (BC) שנכרת אשר בסיכון גבוה להישנות.
מבוא
אחת מכל שמונה נשים תאובחן במהלך חייה כחולה בסרטן השד (BC). בעוד ששכיחות סרטן השד (BC) מראה מגמה הולכת וגדלה, התמותה ירדה במהלך השנים האחרונות, הודות לשיפורים בבדיקות הסקר, באבחון ובטיפולים. אפילו מטופלות עם פרוגנוזה רעה, כלומר, מאובחנות עם הישנות של סרטן השד (BC) = או עם סרטן גרורתי עשויות להשיג הישרדות ארוכת טווח. כמחצית מהמטופלות עם הישנות של סרטן השד (BC) הינן בחיים לאחר 10 שנים, וכשליש מהמאובחנות עם מחלה בשלב IV הינן בחיים לאחר 5 שנים. בהתחשב בפרוגנוזה המשופרת לטווח הארוך בעבור מטופלות עם מאפיינים היסטופתולוגיים של הישנות ו/או של סיכון גבוה, זה חיוני לפתח שיטות לצורך השגת שליטה גבוהה יותר לטווח הארוך. במטופלים אלה, היישום המקביל של טיפולי הקרנות (RT) והיפרתרמיה (HT) מייצגים אפשרות להעצמת הטיפול (treatment intensification), שמטרתו לשפר את השליטה המקומית (LC). מבין המנגנונים הביולוגיים הרבים העומדים בבסיס ההשפעה של היפרתרמיה (HT) כרדיוסנסטיזטור (radiosensitizing), נראה כי חמצון מוגבר בתיווך חום אחראי להגברת נזקי הדנ"א הנגרמים על-ידי טיפולי הקרנות (RT). יתרה מזאת, נראה כי התגובה החיסונית נגד הגידולים (anti-tumor immune response) מועצמת תחת היפרתרמיה (HT). היפרתרמיה (HT) בשילוב עם טיפולי הקרנות (RT) בעבור חולים נבחרים עם סרטן השד (BC) בסיכון גבוה הוכנסו להנחיות הבינלאומיות על בסיס ניסויים אקראיים קטנים ומחקרים רטרוספקטיביים.
מטרת מחקר זה הייתה להעריך את התוצאות ארוכות הטווח של טיפולי הקרנות (RT) והיפרתרמיה (HT) בקבוצה חד-מוסדית גדולה של חולות סרטן השד (BC) שסבלו מהישנות של סרטן השד (BC), בין אם כאלה שנכרתו עם מאפיינים של סיכון גבוה או כאלה שאינם ניתנים לכריתה.
חומרים שיטות
בחירת המטופלים
מחקר רטרוספקטיבי זה אושר על ידי ועדת האתיקה של הפקולטה לרפואה של טיבינגן (Tübingen) (Nr 142/2020BO2). הדרישה להסכמה מדעת לפרסום מחקר זה בוטלה בשל אופיו הרטרוספקטיבי. נותחו הרישומים של מטופלות סרטן השד (BC) שטופלו בטיפולי הקרנות (RT) והיפרתרמיה (HT) בין השנים 1995 ל-2018 בבית החולים האוניברסיטאי בטיבינגן. נתוני תוצאות מוקדמות של תת-קבוצות קטנות של מטופלות שנכללו באנליזה הנוכחית, שטופלו בטיפולי הקרנות חוזרות (RT) בשילוב עם היפרתרמיה (HT) בעבור הישנות של סרטן השד (BC), פורסמו בעבר. במחקר זה, החוקרים מדווחים על התוצאות ארוכות הטווח של קבוצה גדולה יותר, הכוללת מטופלות ללא טיפול קרינתי לפני קבלת טיפולי הקרנות (RT) בשילוב עם היפרתרמיה (HT) ועם האבחנה הראשונה של סרטן השד (BC). האינדיקציות לטיפול בהיפרתרמיה (HT) בשילוב עם טיפולי הקרנות (RT) היו: כריתה של הישנות סרטן השד (BC) או של סרטן שד ראשוני עם שוליי כריתה קרובים (מוגדרים כ-<5 מ"מ עד 2011 ו-<2 מ"מ מ-2012),R1 (מיקרוסקופית), R2 (מקרוסקופית) או בלתי ניתן לניתוח או R0 שנכרתו אך עם תכונות אחרות בסיכון גבוה, למשל, הישנות מרובה, מעורבות מרובה של בלוטות לימפה (nodal), סרטן דלקתי (inflammatory cancer) והתקדמות מקומית(אזורית) לאחר טיפול כימותרפיה אדג'ובנטית.
רדיותרפיה
עבור מטופלות עם הישנות של סרטן השד (BC) שקיבלו בעבר טיפולי הקרנות (RT), נפחי היעד (target volumes) בעבור טיפולי ההקרנות (RT) בשילוב עם היפרתרמיה (HT) הוגדרו באופן אינדיבידואלי לפי השדה המעורב על מנת לכסות את האתר של ההישנות. עבור מטופלים שטרם טופלו ברדיותרפיה (RT-naïve) לפני הטיפולים בהקרנות (RT) והיפרתרמיה (HT), דופן בית החזה עם או בלי אזורי לימפה, בהתאם למעורבות של בלוטות הלימפה (nodal), הוגדר כנפח המטרה. במידת הצורך, למשל על ידי שולי כריתה ממאירים (positive resection margins) או נוכחות של מחלה מקרוסקופית, הוגדר נפח דחף (boost volume). נקבעו מינונים של 50–50.4 Gy ב-25–28 מקטעים (fractions). מנת דחף (boost) הוחלה ברצף עד 60-60.4 Gy או, במקרה של מחלה מקרוסקופית, 70-70.4 Gy אם זה התאפשר מבחינה קלינית. מעשיות יכולת הביצוע הייתה תלויה בקורס רדיותרפיה קודם ובאילוצים של האיברים הנמצאים בסיכון. טיפול בקרינה חיצונית (External beam) בוצע באמצעות 6 או 15 פוטונים MV או אלקטרונים של 4-12 MeV כשדה אחד או כשדות מרובים, או באמצעות טכניקת סיבוב אלקטרונים (electron-rotation technique). מינוני טיפול הרדיותרפיה של הטיפול בקורס הקרינתי הראשון בעבור מטופלים שטופלו ברדיותרפיה לפני הטיפול בהקרנות (RT) בשילוב עם היפרתרמיה (HT) נעו בין 40 ל-66.4 Gy.
היפרתרמיה
כפי שתואר קודם לכן, היפרתרמיה (HT) שטחית בוצעה בהתאם להנחיות ESHO. בקצרה, נעשה שימוש באפליקטור ספירלי (spiral applicator) SA-115 בעל שתי זרועות ((BSD Medical Corp., currently Pyrexar medical, Salt Lake City, UT) המותקן על משטח פרספקס (Plexiglas) המצויד בבולוס מלא במים נטולי-יונים (deionized water). למוליך היפרתרמיה השטחי SA-115 יש גודל שדה אפקטיבי של 13 × 10 סמ"ר. המים בבולוס נשמרו כל הזמן בטמפרטורה של 39 מעלות צלזיוס על מנת לקרר את פני העור ולהימנע מכוויות של העור. צפויה עליית טמפרטורה של 1-2 מעלות צלזיוס בתוך ס"מ אחד מתחת לפני העור. החוקרים עקבו אחר הוראות היצרן של מכשיר ההיפרתרמיה וטיפלו במטרות משטח פני העור עד לעומק מרבי של 3 ס"מ מתחת. שש פרובים של טמפרטורה (temperature probes), שהונחו בין העור לבולוס המים של המוליך היפרתרמיה, שימשו לניטור הטמפרטורה על פני שטח היעד. היפרתרמיה בוצעה פעמיים בשבוע עד לשעה אחת לפני או אחרי טיפולי ההקרנות. לאחר שלב חימום מקדים (preheating) של 5-15 דקות, הוחלה טמפרטורה טיפולית בין 41 ל-42 מעלות צלזיוס למשך שעה אחת. היעד להיפרתרמיה היה המיקום הראשוני של הגידול על פי הדמיות טרום-ניתוחיות וקליפסים לאחר-ניתוח ו/או צלקת או הגידול המקרוסקופי, במידה וקיים.
נקודות קצה וניתוח סטטיסטי
נקודת הקצה העיקרית הייתה שליטה מקומית (LC). נקודות הקצה המשניות היו רעילות, הישרדות כוללת (OS) והישרדות ללא התקדמות (PFS). אירועים (הישנות, התקדמות או מוות) תוזמנו מתחילת טיפולי הקרנות (RT) בשילוב עם היפרתרמיה (HT). רעילות אקוטית ומאוחרת קיבלו ניקוד על פי קריטריוני הרעילות של CTC AE וקריטריוני הרעילות של LENT-SOMA/RTOG, בהתאמה. על מנת להגדיר רעילות מאוחרת, נעשה שימוש בנקודת חתך של 3 חודשים לאחר סיום הטיפול הקרינתי. בוצעו ניתוחי תת-קבוצות על פי קורס טיפול קרינה קודם ואבחנה ראשונה של סרטן השד (BC). גורמים הקשורים למטופל, לגידול ולטיפול נכללו באנליזה חד-משתנית ורב-משתנית. ניתוח חד-משתני בוצע באמצעות מודל קוקס (Cox model) וחושבו יחסי סיכון (hazard ratios-HRs) ומרווחי סמך של 95% (confidence intervals-CIs). הפרמטרים שנלקחו בחשבון לצורך הניתוח החד-משתני היו: שלב הגידול, שלב בלוטות הלימפה (nodal stage), נוכחות של גרורות מרוחקות, ביטוי אסטרוגן/פרוגסטרון (ER/PR), ביטוי Her2, דירוג, שולי כריתה, מינון הרדיותרפיה, טמפרטורת היפרתרמיה ממוצעת, טמפרטורת היפרתרמיה מינימלית, טמפרטורת היפרתרמיה מקסימלית ומספר מקטעי ההיפרתרמיה (HT fractions) שיושמו. אינדקס הפרוליפרציה (Proliferation index), מרכיבי הגידול באתרו (in situ tumor) חדירה לימפו-וסקולרית (lymphovascular invasion) לא היו זמינים עבור רוב המטופלים ולכן לא נכללו. נעשה שימוש במבחן לוג-הדרגות (log-rank) מנטל-קוקס (Mantel-Cox) לצורך השוואה וערכי p <0.05 נחשבו למובהקים סטטיסטית. פרמטרים עם p < 0.1 נכללו בניתוח הרב-משתנים. הניתוח הסטטיסטי בוצע באמצעות GraphPad Prism גרסה 9 עבור Windows (GraphPad Software, La Jolla, CA, USA). הניתוח רב משתנים בוצע על-ידי SPSS גרסה 25 (IBM, Armonk, NY, USA).
תוצאות
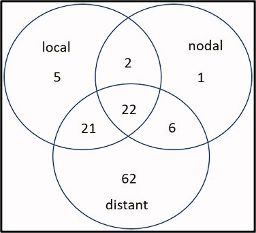
בסך הכל בוצעו 196 טיפולי הקרנות בשילוב עם היפרתרמיה ב-191 מטופלים עם סרטן השד (BC) בין השנים 1995 ל-2018. רוב המטופלים (n = 154, 78.6%) טופלו בעבור הישנות ו-42 (21.4%) בעבור סרטן שד ראשוני. מבין אלו עם הישנות של סרטן השד, 93 (47.4% מכלל הקבוצה) מהם כבר קיבלו טיפולי הקרנות לפני הטיפול הקרינתי בשילוב עם היפרתרמיה (HT). מאפייני המטופל והטיפול מוצגים בטבלה 1. המעקב החציוני היה 12.7 שנים (טווח, 0.9-22). בסך הכל נצפו 111 הישנות. מתוכם, 50 היו הישנות מקומית. עם זאת, רק 10% (n = 5/50) היו הישנות מקומית מבודדת (איור1)
להלן איור 1: התפלגות אירועי הישנות על פי אתר ההישנות (מקומי, אזורי או מרוחק).
להלן טבלה 1: מאפייני המטופלים, הגידול והטיפול בזמן הטיפול עם הקרנות בשילוב היפרתרמיה

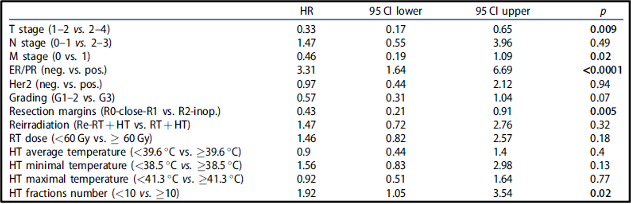
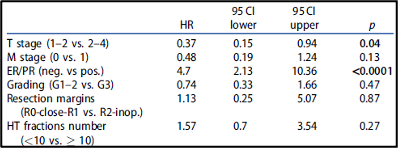
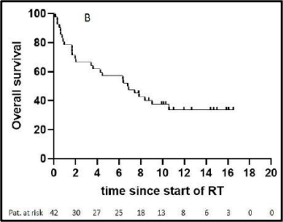
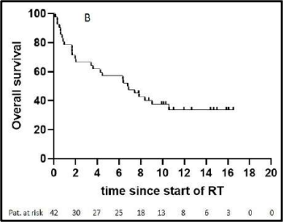
השליטה המקומית (LC) לאחר שנתיים, 5 ו-10 שנים הייתה 76.4%, 72.8% ו-69.5%, בהתאמה. ההישרדות הכוללת (OS) לאחר שנתיים, 5 ו-10 שנים הגיעה ל-73.5%, 52.3% ו-35.5%, בהתאמה. ההישרדות ללא התקדמות (PFS) לאחר שנתיים, 5 ו-10 שנים הייתה 55.6%, 41% ו-33.6%, בהתאמה. שלב הגידול (p = 0.009, HR 0.33, CI 0.17-0.65), גרורות מרוחקות (p = 0.02, HR 0.46, CI 0.19-1.09), ביטוי ER/PR (p < 0.0001, HR 3.31, CI 1.64-6.69), סטטוס הכריתה (p = 0.005, HR 0.43, CI 0.21-0.91) ומספר מקטעי ההיפרתרמיה (≥10, p = 0.02, HR 1.92, CI 1.05–3.54) נמצאו כגורמי ניבוי בעבור השליטה המקומית (LC) (טבלה 2, איור 2). הוצגה מגמה לדירוג גידולים (p = 0.07, HR 0.57, CI 0.31-1.04), מינוני קרינה (p = 0.18, HR 1.46, CI 0.82-2.57) וטמפרטורת היפרתרמיה מינימלית (p = 0.13, HR 1.56, CI 0.83-2.98). בניתוח הרב-משתנים, שלב הגידול (p = 0.04, HR 0.37, CI 0.15-0.94) וביטוי ER/PR (p < 0.0001, HR 4.7, CI 2.13-10.36) נשארו מובהקים סטטיסטית (טבלה 3).
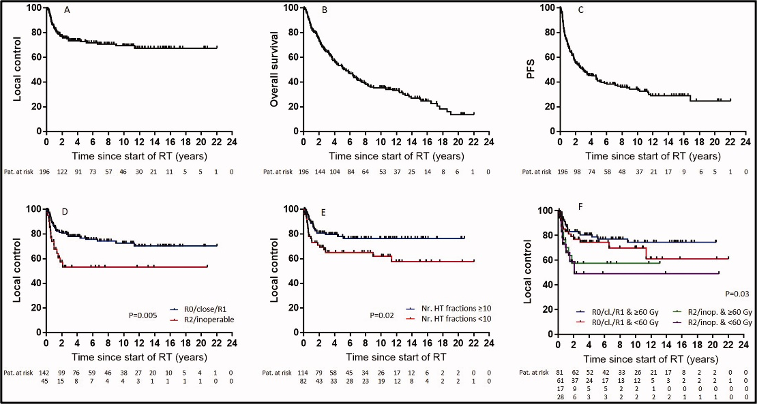
להלן איור 2: עקומות קפלן-מאייר -(A)שליטה מקומית (LC), (B)הישרדות כוללת (OS) ,(C)הישרדות ללא התקדמות (PFS), (D)שליטה מקומית לפי סטטוס כריתה, (E)מספר מקטעי ההיפרתרמיה, (F)סטטוס כריתה משולב עם מינון קרינה מיושם
להלן טבלה 2: ניתוח חד-משתנים עבור שליטה מקומית
להלן טבלה 3: ניתוח רב-משתנים עבור שליטה מקומית.
בוצעה אנליזה של תת-קבוצות על 42 המטופלים שקיבלו טיפולי הקרנות בשילוב עם היפרתרמיה בזמן האבחנה הראשונית של סרטן השד (BC). השליטה המקומית (LC) לאחר שנתיים, 5 ו-10 שנים הייתה 80.8% ו-77.3%, בהתאמה (איור משלים 1A). ההישרדות הכוללת (OS) לאחר שנתיים, 5 ו-10 שנים הייתה 66.7% ו-37.5% (איור משלים 1B).
להלן איור משלים 1: (A)שליטה מקומית ו(B)הישרדות כוללת, במטופלים שקיבלו הקרנות עם היפרתרמיה בזמן האבחנה הראשונית
לתשעה מטופלים (4.6%) לא הייתה תגובה אקוטית בעור, 76 (38.6%) חוו רעילות CTC AE דרגה 1, ל-92 מטופלים (46.7%) הייתה רעילות בדרגה 2 ול-18 מטופלים (9.1%) הייתה רעילות בדרגה 3. לא נצפתה רעילות אקוטית גבוהה יותר מדרגה 3. רעילויות אקוטיות נוספות שדווחו היו עייפות, כאב, בצקת בשדיים, בצקת בזרועות, אף אחת מהן לא גבוהה יותר מדרגה 2. פנאומיניטיס על רקע קרינה (Radiation pneumonitis) נצפתה בשישה מקרים. במטופל אחד שתועד על ידי ממצאי CT ללא תסמינים (RTOG דרגה 1) ובחמישה מטופלים הסימפטומים חלפו לאחר טיפול בסטרואידים (דרגה 2). תופעות לוואי אקוטיות אחרות הקשורות להיפרתרמיה היו טכיקרדיה וחום, שאף אחת מהן לא הייתה גבוהה יותר מדרגה 2. עבור שני מטופלים (1%), לא היו נתונים זמינים על רעילות אקוטית.
בנוגע לרעילות מאוחרת בעור, אצל 55 (27.9%) מטופלים לא נצפו תופעות לוואי. 45 מטופלים (22.8%) חוו רעילות בדרגה 1, 13 מטופלים (6.6%) רעילות בדרגה 2 ו-9 מטופלים (4.6%) רעילות בדרגה 3. רעילויות מאוחרות אחרות שנבדקו כגון פיברוזיס (fibrosis), טלנגיאקטזיה (telangiectasia), בצקת, כאב ועייפות, לא עלו מעל לדרגה 2. במקרה אחד עלה חשד לפגיעה במקלעת הברכיאלית (Radiation-induced brachial plexus injury) הנגרמת על ידי קרינה. מטופל זה הוקרן 6 שנים קודם לכן עם 50 Gy ועם 59.4 Gy בזמן טיפולי ההקרנות בשילוב עם היפרתרמיה והיה לו גידול בלתי ניתן לניתוח. מטופל אחד סבל מבעיות ממושכות בריפוי פצעים. נתוני רעילות מאוחרת לא היו זמינים עבור 75 (38.1%) מטופלים.
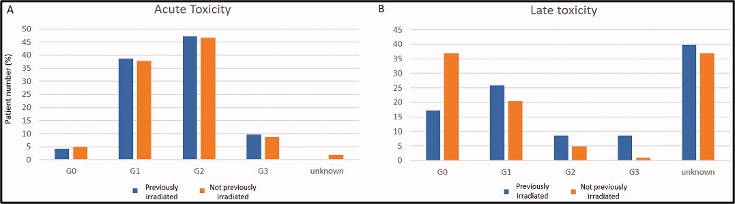
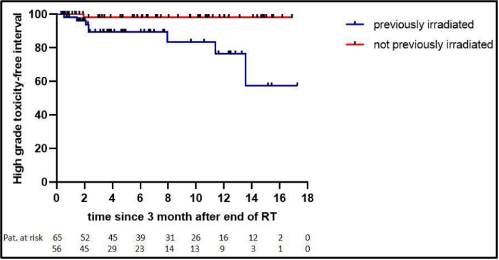
בוצע ניתוח רעילות תת-קבוצתי בין מטופלים שכבר קיבלו טיפולי הקרנות לפני הטיפול הקרינתי בשילוב עם היפרתרמיה (HT) (n = 93) לבין אלה שלא קיבלו לפני (n = 103). הרעילות האקוטית הייתה דומה בין שתי הקבוצות: דרגות 0, 1, 2 ו-3 היו 4.3%, 38.7%, 47.3% ו-9.7%, בהתאמה, עבור אלה שכבר קיבלו טיפולי הקרנות לפני הטיפול הקרינתי בשילוב עם היפרתרמיה, ו-4.9%, 37.9%, 46.6% ו-8.7%, בהתאמה, עבור אלה שלא קיבלו (איור 3(A)). במקום זאת, מטופלים שכבר קיבלו טיפולי הקרנות לפני הטיפול הקרינתי בשילוב עם היפרתרמיה הראו רעילות מאוחרת בדרגה 2 ובדרגה 3 גבוהה יותר בהשוואה לאלה שלא הוקרנו קודם לכן, כלומר, 8.6% דרגה 2 ו-8.6% דרגה 3 אם הוקרנו קודם לכן, לעומת 4.9% דרגה 2 ו-1% דרגה 3 במידה ולא (איור 3(B)). ההבדל ברעילות בדרגה גבוהה (מוגדרת כדרגה 3) בין שתי תת-הקבוצות היה מובהק סטטיסטית (p = 0.004, איור משלים 2).
להלן איור 3: (A) רעילות עור אקוטית (B) רעילות עור מאוחרת
להלן איור משלים 2: רעילות מאוחרת בדרגה גבוהה לאחר 3 חודשים מרגע סיום הטיפול בהקרנות
דיון
טיפולי היפרתרמיה וטיפולי הקרנות בו-זמנית הביאו לשליטה מקומית (LC) יציבה לטווח ארוך של 70% לאחר מעקב חציוני של יותר מ-12 שנים בקבוצה הנוכחית במחקר של מטופלות עם סרטן השד (BC) בסיכון גבוה. ניתוח הוא הטיפול הבחירה בעבור מטופלים עם הישנות של סרטן השד. עם זאת, כשליש מהמטופלים חווים הישנות לאחר הניתוח בלבד וכ-30% מההישנויות המקומיות אינן ניתנות לניתוח. בעבור מטופלים עם הישנות של סרטן השד, במיוחד אם הוקרנו בעבר ו/או עם גידולים R0 שלא נכרתו (not R0-resected) או שאינם ניתנים לכריתה, היתרון של השימוש בהיפרתרמיה בנוסף לטיפולי ההקרנות מתועד היטב. היישום של היפרתרמיה בהישנות של סרטן השד R0 שנכרת (R0-resected recurrent BC) או עבור מטופלים עם האבחנה הראשונה של סרטן השד בסיכון גבוה להישנות מקומית (כלומר, מאפיינים היסטופתולוגיים אגרסיביים ו/או R0 שלא נכרת) תואר בספרות, אולם עם יתרונות פחות ברורים. נכללו בניתוח מטופלים עם סרטן השד שטופלו בצורה הומוגנית עם טיפולי הקרנות בשילוב עם היפרתרמיה במשך כמעט שלושה עשורים. בקבוצה זו, כמעט 80% מהמטופלים טופלו בהישנות של סרטן השד. כפי שניתן היה לצפות, בקרב המטופלים שטופלו בזמן שקיבלו את האבחנה הראשונה שלהם, שיעורי השליטה מקומית (LC) וההישרדות הכוללת (OS) היו טובים יותר בהשוואה לקבוצה כולה (80.7% לעומת 76.4% ו-77.3% לעומת 69.5% שליטה מקומית (LC) בשנתיים ו-66.7% לעומת 73.5% ו-37.5% לעומת 35.5% הישרדות כוללת (OS) בשנתיים ו-10 שנים, בהתאמה).
מכיוון שנקודת הקצה העיקרית הייתה שליטה מקומית (LC), החוקרים כללו גם מטופלים עם גידולים גרורתיים, למרות שרובם הגדול (70%) היה בדירוג M0. במהלך השנים האחרונות, המחלקה של החוקרים צמצמה את האינדיקציות בעבור מתן טיפולי הקרנות בשילוב עם היפרתרמיה, לטיפול בהישנות של סרטן השד, במיוחד במידה והמטופל עבר הקרנות בעבר, על פי ההנחיות. אף על פי כן, החוקרים טיפולו בעבר גם במטופלים עם סרטן שד בלתי ניתן לניתוח שאובחן לאחרונה, או במטופלים שעברו כריתה של סרטן שד הנמצא בסיכון גבוה להישנות, למשל, גידולים R0 שלא נכרתו (non R0-resected tumors), והחוקרים כללו מטופלים אלו במחקר הנוכחי גם כן. השימוש הנרחב בהיפרתרמיה (HT) בתרחישים אונקולוגיים מרובים, כולל סרטן השד בסיכון גבוה שאובחן לאחרונה, נעשה רציונלי, באמצעות העובדה שהיפרתרמיה ידועה מזה עשרות שנים בהיותה רדיוסנסטיזטור (radiosensitizer) רב עוצמה, עם יחס שיפור תרמי (thermal enhancement ratio) של כ-2.5. כצפוי, החוקרים הבחינו בתוצאות טובות יותר בקרב מטופלים עם גידולים עם R0, קרובים או R1 שנכרתו. אף על פי כן, מתוך 45 המטופלים עם גידולים מקרוסקופיים (R2 שנכרתו או לא ניתנים לכריתה), ל-15 לא הייתה התקדמות מקומית שנתיים לאחר הטיפול (איור 2(D)), עם כ-60% שליטה מקומית (LC) לאחר שנתיים אצל אלו שקיבלו לפחות 60 Gy (איור 2(F)). תוצאות אלו עולות בקנה אחד עם אלו של Linthorst ואח’., אשר תיעדו שליטה מקומית (LC) של 53% לאחר שנה אחת במטופלים עם הישנות של סרטן השד בלתי ניתנות לניתוח שטופלו על ידי לוח זמנים פליאטיבי (palliative schedule) של 32 Gy ב-8 מקטעים בשילוב עם היפרתרמיה. קבוצות מחקר רבות דיווחו על שימוש בלוחות הזמנים של טיפול בשיטת קרינה היפופרקציונציה (hypofractionated RT) עם מינונים של בערך 30 Gy לטיפול בסרטן השד בשילוב עם היפרתרמיה (HT). הדיון על מינון טיפולי הקרנות (RT) עדיין פתוח, במיוחד בנוגע למינונים גבוהים יותר, כמו אלה שבהם השתמשו החוקרים, שעלולים לגרום לרעילות רבה יותר, במיוחד אצל אותם מטופלים שכבר קיבלו קורס טיפולי הקרנות.
היעילות הגבוהה יותר של טיפולי הקרנות בשילוב עם היפרתרמיה בהשוואה לטיפולי בקרינה בלבד עבור מטופלות עם סרטן השד, תועדה במטא-אנליזה של חמישה מחקרים אקראיים קטנים שנערכו לפני יותר מ-30 שנה. בהיעדר מחקרים אקראיים בשלב 3, שנערכו לאחרונה ושהפיקו ראיות המשוות בין טיפולי הקרנות בשילוב עם היפרתרמיה לבין טיפולי הקרנות בלבד, יש לשים את הנתונים הללו של החוקרים בהקשר באמצעות השוואה עם קבוצות של מטופלים שטופלו בטיפולי הקרנות בלבד. אפילו אם לוקחים בחשבון רק מקרים שבהם נעשה שימוש במינוני הקרנה חוזרת של 50 Gy או יותר, כלומר, למעט אלה שבהם יושמו טיפולי הקרנה חוזרת עם מינונים פליאטיביים, שיעורי השליטה המקומית (LC) משתנים במידה רבה. Merino ואח’. דיווחו על קבוצה של כ-47 מטופלים שטופלו בטיפולי הקרנות חוזרות בעבור הישנות של סרטן השד על שיעורי שליטה מקומית (LC) של 50% לאחר שנתיים. שליטה מקומית (LC) לאחר שנתיים בין 60% ל-75% דווחה לאחר הקרנה חוזרת עם ברכיתרפיה (brachytherapy). בעקבות הקרנה חוזרת (reirradiation) לאחר ניתוח שמרני שני של השד (breast conservative surgery), דווח על שליטה מקומית (LC) של עד 90% לאחר 5 שנים. Fattahi ואח’. תיעדו לאחרונה הישרדות ללא הישנות מקומית-אזורית (locoregional recurrence-free survival) של 74% לאחר שנתיים. טווח רחב זה של שונות עשוי להיות תלוי באופי המעורב של הקבוצות של המטופלות, במיוחד לגבי שלב הגידול, סוג הניתוח והגידול השיורי (residual tumor) לאחר הניתוח, כאשר שיעורי השליטה המקומית (LC) הגבוהים יותר, דווחו לאחר ניתוח שני לשימור שד (breast-conserving surgery) שנעשה בעבור הישנות מבודדת בשד שהתגלתה מוקדם וכריתת R0. עתה החוקרים מדווחים על שיעורי שליטה מקומית (LCs) של 76% לאחר שנתיים ו-70% לאחר 10 שנים, עם חמש הישנויות מקומיות מבודדות בלבד. התוצאות הללו של החוקרים מעודדות, בהתחשב באופי הקבוצות במחקר, כלומר, כולל מטופלים עם מחלה מקרוסקופית בלתי ניתנת לניתוח וגרורות מרוחקות. לצורך תמיכה בחשיבות קריטריוני הבחירה של המטופלים בקביעת התוצאות, לאחר טיפולי הקרנות בשילוב עם היפרתרמיה, הערכה פרוספקטיבית על קבוצה של 20 מטופלים נבחרים שטופלו בהקרנות חוזרות בשילוב עם היפרתרמיה, תועדה על ידי החוקרים שליטה מקומית (LC) של כ-90% לאחר שנתיים.
באשר הסבילות לטיפול, קבוצה זו של מטופלים שהוקרנו בעבר הראו יותר רעילות מאוחרת בדרגות 2 ו-3 בהשוואה לאלה שלא הוקרנו קודם לכן. עם זאת, החוקרים לא הבחינו ברעילות אקוטית או מאוחרת הגבוהה מדרגה 3 ורוב המטופלים פיתחו רעילות מאוחרת בדרגה 1 בלבד.
נצפתה מגמה לקראת שליטה מקומית (LC) טובה יותר בהתאם למינון המיושם (טבלה 1, איור 1(F)), התואמת את התוצאות הקודמות של החוקרים. החוקרים הבחינו בשליטה מקומית (LC) טובה יותר במטופלים שקיבלו יותר מ-10 טיפולי היפרתרמיה. מכיוון שרוב המטופלים במחקר הנוכחי טופלו במינוני קרינה של 50 Gy או יותר (טבלה 1), ובמקביל ניתנו שני טיפולים של היפרתרמיה בשבוע, מטופלים שקיבלו לפחות 10 טיפולי היפרתרמיה, היו אלה שהשלימו טיפולי היפרתרמיה (HT) כפי שנקבעו בתחילה (5 שבועות של טיפולי הקרנות ולבסוף הוספת של מנת דחף [boost] בשבוע השישי או השביעי). בנוגע לטמפרטורת ההיפרתרמיה (HT), נצפתה מגמה לעבר שליטה מקומית (LC) טובה יותר כאשר יושמה טמפרטורה מינימלית של 38.5 מעלות צלזיוס (הטמפרטורה הממוצעת בכל העוקבה). במאמר שפורסם לאחרונה, Bakker ואח’. הבחינו כי הדקות המקבילות המצטברות (cumulative equivalent minutes) בטמפרטורה של 43 מעלות צלזיוס (המשלבת מידע על הטמפרטורה החציונית ומשך הטיפול) מתואמות עם שליטה מקומית-אזורית (locoregional control) טובה יותר במטופלים שטופלו בהקרנות חוזרות בשילוב עם היפרתרמיה בעבור הישנות של סרטן השד. טמפרטורות אלו נמדדו באמצעות בדיקות פולשניות (invasive probes). לעומת זאת, הטמפרטורות שנרשמו נמדדו באמצעות בדיקות שטחיות שהונחו על עורו של המטופל, ויש לצפות לטמפרטורה הגבוהה בערך בכ-2 מעלות צלזיוס מהמדידה של פני השטח באזור המטרה.
המגבלות של המחקר הנוכחי כוללות את אופיו הרטרוספקטיבי, לעתים חסר נתוני מעקב ורעילות, האחרון עם סיווגים שונים במשך שלושה עשורים. כאן יש לציין כי החוקרים כללו מטופלים שטופלו לפני יותר מ-30 שנה. בשל כך, למרות שהם ביצעו בדיקה מדוקדקת ומעמיקה של רשומות המטופלים, לא ניתן היה לשפר את איכותם של חלק מהנתונים, לרבות מאפייני גידול פתולוגיים, מדידות טמפרטורה שטחיות, כמו גם, כפי שכבר הוזכר, נתוני המעקב והרעילות. מגבלה נוספת נובעת מהטבע המעורב של העוקבה הנוכחית, כולל מטופלים עם פרוגנוזות פוטנציאליות שונות, כלומר, הישנות של סרטן השד וסרטן שד ראשוני, כמו גם כמה מטופלים עם מחלה בדירוג M1 נכללו. נקודת החוזקה של אנליזה זאת היא מספר גדול של מטופלים והמעקב ארוך הטווח.
לסיכום, החוקרים במחקר הנוכחי יכלו לצפות בקבוצה גדולה של מטופלים עם מעקב ארוך טווח ששילוב של טיפולי הקרנות עם היפרתרמיה הציע שיעורי שליטה מקומית (LC) גבוהים עבור מטופלים שסבלו מהישנות של סרטן השד, שאינו ניתן לכריתה, או סרטן שד שנכרת הנמצא בסיכון גבוה להישנות, עם רעילות קונבנציונלית. אימות נוסף, כולל הערכה פרוספקטיבית של איכות חיים ונתוני התוצאות המדווחות על-ידי המטופלים וכמו כן מדדי ניסיון (PROMs/PREMs) נמשך כעת (NCT04878666).



