The role of hyperthermia in the treatment of locally advanced cervical cancer: a comprehensive review
International Journal of Gynecological Cancer (IJGC)
Marloes IJff1,2, Johannes Crezee1, Arlene L Oei1,2, Lukas J A Stalpers1,2, Henrike Westerveld1
Department of Radiation Oncology, First Affiliated Hospital of Xi’an Jiaotong University, Xi’an, Chin
- Department of Radiation Oncology, Amsterdam University Medical Centres, Cancer Centre Amsterdam, University of Amsterdam, Amsterdam, The Netherlands
- Laboratory for Experimental Oncology and Radiobiology (LEXOR), Cancer Centre Amsterdam, University of Amsterdam, Amsterdam, The Netherlands
תקציר
רדיותרפיה עם ציספלטין (כימורדיותרפיה) הוא הטיפול הסטנדרטי לנשים עם סרטן צוואר הרחם מקומי מתקדם. רדיותרפיה עם היפרתרמיה עמוקה (תרמו-רדיותרפיה) הינה אלטרנטיבה מבוססת היטב, אולם לעתים נדירות מוצעת כחלופה לטיפול כימורדיותרפיה, במיוחד בעבור חולים עם התוויות נגד לציספלטין. מטרת סקירה זו היא לספק סקירה כללית על הרציונל הביולוגי שעומד מאחורי מתן טיפול בהיפרתרמיה, כולל תזרים העבודה של המטופל, והיעילות הקלינית של היפרתרמיה כגורם רדיוסנסיטיזציה בטיפול בסרטן צוואר הרחם. היפרתרמיה יעילה במיוחד באזורים בגידול שהם במצב היפוקסי ובמחסור ברכיבים תזונתיים, בהם טיפול בקרינה פחות יעיל. יעילותה כרדיוסנסטיזטור תלויה ברמת הטמפרטורה, משך הטיפול ובמרווח הזמן בין טיפול בקרינה להיפרתרמיה. טיפול היפרתרמיה איכותי דורש צוות מנוסה ותכנון טיפול הסתגלותי הולם בזמן אמת, ורצוי שהטיפול יבוצע באמצעות מכשיר היפרתרמיה מקומי-אזורי קרינתי של מערך מבוקר (phased array radiative) על מנת להשיג את אפקט המינון התרמי האופטימלי. היפרתרמיה נסבלת היטב ובדרך כלל מובילה לרעילות קלה בלבד, כגון אי נוחות למטופל. לכן יש להפנות מטופלים אשר להם יש התוויות נגד לטיפול בציספלטין למרכז היפרתרמיה לצורך תרמו-רדיותרפיה (thermoradiation).
מבוא
סרטן צוואר הרחם הוא הסרטן הרביעי בשכיחותו בקרב נשים ברחבי העולם, במיוחד במדינות לא מפותחות, עם כ-570,000 מקרים חדשים של סרטן צוואר הרחם ויותר מ-300,000 מקרי מוות כתוצאה מממאירות זו בשנת 2018. סרטן צוואר הרחם נובע לרוב מזיהום מתמשך בנגיף הגורם סרטן- הפפילומה (human papillomavirus) מסוגים 16 ו-18. רדיותרפיה בשילוב כימותרפיה מבוססת ציספלטין כרדיוסנסטיזטור (כימורדיותרפיה) הוא הטיפול הסטנדרטי לנשים עם סרטן צוואר הרחם מקומי מתקדם. רדיותרפיה עם היפרתרמיה עמוקה היא אלטרנטיבה מבוססת. היפרתרמיה היא טכניקה שכבר זכתה לעניין בתחום הרפואה בשנת 1898 על ידיFrans Westermark; הוא היה הרופא הראשון שהשתמש בחימום מקומי של הגידול לטיפול בסרטן צוואר הרחם, על ידי הזרמת מים מחוממים דרך סליל מתכת. את עבודתו המשיך בנו, Nils Westermark, שהעלה השערה כי רקמת הגידול תהיה רגישה יותר לחום מרקמה בריאה. בשנות ה-30, הרדיולוג Kristian Overgaard ערך ניסוי העסק בשילוב של היפרתרמיה והקרנות (תרמו-רדיותרפיה), והראה שליטה טובה יותר בגידול עם תרמו-רדיותרפיה בהשוואה לטיפול בקרינה בלבד. היפרתרמיה, המוגדרת על ידי חימום מקומי של הגידול עד ל42 מעלות צלזיוס במשך כ-60 דקות, שימשה כטיפול רדיוסנסיטיזציה אלטרנטיבי בנשים בהן ציספלטין (cisplatin) הינו קונטרה-אינדיקציה לטיפול בסרטן גינקולוגי, כגון סרטן הנרתיק וצוואר הרחם. על אף שהיפרתרמיה עמוקה התקבלה באופן נרחב כגורם רדיוסנסיטיזציה, היפרתרמיה מוצעת רק לעתים רחוקות כחלופה לציספלטין. למרות העדויות, קרבופלטין (carboplatin) מוצעת לרוב כחלופה לציספלטין, אף על פי שיש פחות עדויות לכך שזה עובד באותה מידה.
מטרת מאמר זה היא לספק סקירה כללית של הנתונים הקליניים בנוגע ליעילות של היפרתרמיה כגורם רדיוסנסיטיזציה באמצעות היפרתרמיה עמוקה (deep hyperthermia) בחולי סרטן צוואר הרחם, הרציונל הביולוגי התומך בשימוש בה, תזרים העבודה של המטופל והציוד שנעשה בו שימוש.
אסטרטגיית החיפוש ובחירת קריטריונים
חיפוש ספרות שיטתי נערך כדי לקבל סקירה של העדויות הקיימות של היפרתרמיה בטיפול בסרטן צוואר הרחם. קריטריוני ההכללה היו: מחקרים קליניים מקוריים שפורסמו לאחר שנת 2000, נכתבו באנגלית, וכללו לפחות 40 מטופלים. בנוסף, נכללו רק מחקרים עם כוונה מרפאה. אם אותה קבוצת חולים דווחה בעיתונים נוספים, רק הפרסום האחרון נכלל. לבסוף, בוצעה בדיקת הצלבה של סימוכין.
חיפושים ב-PubMed בוצעו עם מושגי החיפוש הבאים:
“((cervical cancer, uterine (MeSH Terms)) AND (hyperthermia, induced (MeSH Terms))) or ((cervical cancer, uterine (MeSH Terms)) AND (radiotherapy (MeSH Terms)) AND (hyperthermia, induced (MeSH Terms)) or ((cervical cancer, uterine (MeSH Terms)) AND (radiotherapy (MeSH Terms)) AND (hyperthermia, induced (MeSH Terms)) AND (cisplatin (MeSH Terms))) or (((cervical cancer, uterine (MeSH Terms)) AND (hyperthermia, induced (MeSH Terms)) AND (cisplatin (MeSH Terms))).
רקע רדיו-ביולוגי
היפרתרמיה וציספלטין (cisplatin) הינם רדיוסנסיטייזרים פוטנטיים. שניהם משמשים להגברת ההשפעות הציטוטוקסיות של קרינה מייננת על תאים סרטניים. רדיותרפיה וכימותרפיה מבוססת ציספלטין נועדו לגרום נזק קטלני לדנ"א, כאשר שברים דו-גדילים בדנ"א נחשבים לקטלניים ביותר. קרינה מייננת משרה שברים דו-גדילים של דנ"א במישרין ובעקיפין. אינדוקציה של שברים בדנ"א מפעילה באופן מידי מסלולים לתיקון שברים דו-גדילים בדנ"א. ישנם שני מסלולים עיקריים לתיקון שברים דו-גדילים בדנ"א: רקומבינציה הומולוגית ותיקון דנ"א לא הומולוגי. היפרתרמיה יכולה לעכב באופן זמני את תיקון הדנ"א דרך מסלול הרקומבינציה ההומולוגית ומסלול לתיקון דנ"א לא-הומולוגי, כתוצאה מכך גורמת להצטברות של שברי דנ"א שלא תוקנו. יעילות ההיפרתרמיה תלויה ברמת הטמפרטורה, משך הטיפול ומרווח הזמן בין הקרינה המייננת להיפרתרמיה. לכן, השילוב של קרינה מייננת או כימותרפיה מבוססת-ציספלטין עם טיפול נכון בהיפרתרמיה (כלומר, לכדי-42 מעלות צלזיוס במשך 60 דקות), גורם לאינדוקציה גבוהה יותר של שברים בדנ"א, לפחות תיקון דנ"א, ובסופו של דבר למוות מוגבר של תאי הגידול (איור 1A). היפרתרמיה בשילוב עם כימותרפיה נחשבת כמובילה לאפקט סינרגטי, ולא רק כאפקט הוספה בלבד.
להלן איור A1: היפרתרמיה יכולה לעכב באופן זמני את מנגנוני התיקון לנזק בדנ"א שנגרם על ידי רדיותרפיה או כימותרפיה וכתוצאה מכך לגרום להרג מוגבר של תאי גידול.
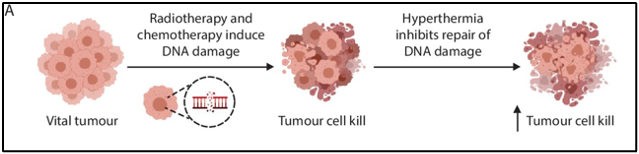
היפרתרמיה תורמת למספר השפעות ביולוגיות הן על הגידול והן על המיקרו-סביבה של הגידול (איור 1B). כפי שכבר היה ידוע בשנות השמונים, אזורים היפוקסיים בגידול הם עמידים לקרינה (radioresistant), היפרתרמיה יכולה להתגבר על עמידות זו על ידי הריגת תאים אלה באופן ישיר בטמפרטורות גבוהות יותר. בנוסף, חמצון מוגבר של הגידול משפר את היעילות של קרינה מייננת. היפרתרמיה יעילה במיוחד באזורים היפוקסיים של הגידול הסובלים ממחסור בחומרי הזנה, שבהם הקרנות וכימותרפיה יעילות פחות. היפרתרמיה מקומית משפרת את אספקת הדם של הגידול, וכתוצאה מכך נגרמת צמצום העמידות לקרינה הקשורה להיפוקסיה. בטמפרטורות נמוכות יחסית של 39-40 מעלות צלזיוס, הפרפוזיה והחמצון גדלים, גורמים לשינויים ב- pH ובכך משנים ומשפיעים על המיקרו-סביבה של הגידול. רמות חמצן גבוהות יכולות להגביר את שברי הדנ"א הנגרמים על ידי קרינה ולקבע את הנזק לדנ"א, מה שמקשה על תיקון השברים הללו. יתר על כן, נמצא כי היפרתרמיה "מושכת" תאי חיסון לאזור הגידול. בטמפרטורות גבוהות יותר של עד 43 מעלות צלזיוס, היפרתרמיה יכולה לעכב באופן זמני את מסלולי תיקון הנזק לדנ"א, ובכך לגרום לעצירת מחזור התא, אשר מוביל לאחר מכן למוות תאי כגון אפופטוזיס (איור 1B).
להלן איור B1: להיפרתרמיה יש השפעות הן על המיקרו-סביבה של הגידול והן על התא עצמו. כבר ב39 מעלות היפרתרמיה יכולה להפריע לסביבת הגידול על ידי הגברת הפרפוזיה והחמצון מחדש.
כאמור, יעילות ההיפרתרמיה תלויה בגורמים שונים, לרבות רמת הטמפרטורה, משך הטיפול ההיפרתרמיה, והרצף ומרווח הזמן בין ההקרנות להיפרתרמיה. הראיות מצביעות על כך שטיפול בהקרנות והיפרתרמיה בו-זמנית נותנים את השיפור הגבוה ביותר, ולכן יש לשמור על מרווח הזמן בין היפרתרמיה לקרינה מייננת קצר ככל האפשר, רצוי בתוך כשעה. מרווחי זמן ארוכים יותר יפגמו בעיכוב תיקון נזקי הדנ"א עקב יעילות פחותה של ההיפרתרמיה, וכתוצאה מכך יובילו להגברת ההישרדות של תאי הגידול. למרות שאחרים לא מצאו הבדלים משמעותיים בתוך 1-4 שעות, ניתוח מקרוב מצביע על כך שעל מרווח הזמן אין לעלות מעל לשעה אחת לניצול מלא של השפעות ההיפרתרמיה. חלק מהפרוטוקולים הקליניים לסרטן השד מיישמים כמעט בו זמנית עם מרווחי זמן של כ5 דקות בין היפרתרמיה להקרנות, עם זאת, מרווחים קצרים כאלה אינם מעשיים בטיפול בסרטן צוואר הרחם.
תוצאות
מכשירי ההיפרתרמיה –
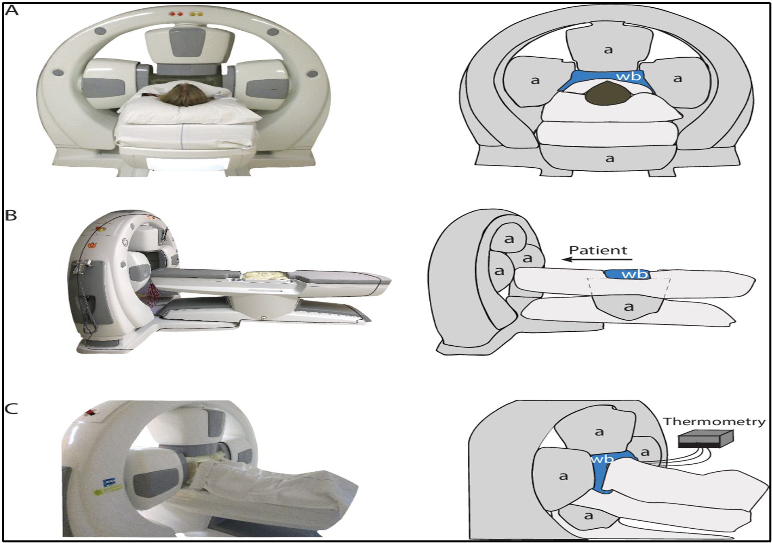
מכשירי ההיפרתרמיה המשמשים כיום לטיפול מקומי-אזורי בגידולים עמוקים, לרבות סרטן צוואר הרחם, משתמשים באנרגיה אלקטרומגנטית וניתן לחלקם לשני סוגים של מערכות, קרינתית וקיבולית. מכשירי חימום קרינתיים (Radiative heating) הם מערכים מדורגים של 4-12 אנטנות הממוקמות סביב האגן של המטופל, הפועלות במהירות 70-150 MHz. מכשירי חימום קיבוליים (Capacitive heating) פועלים במהירות 8-13 MHz ומשתמשים בשתי אלקטרודות הממוקמות בצד הונטרלי (ventral) והדורסלי (dorsal) של האגן. בעבור שני המכשירים, בולוס מים מקורר ממוקם בין האנטנה או האלקטרודה לבין העור כדי למנוע התחממות יתר של העור. טמפרטורות גידול טיפוליות מתאימות מושגות בקלות רבה יותר באמצעות מכשירים קרינתיים בשל הסיכון לטיפול המגביל טמפרטורות עור מופרזות בעת שימוש במכשירים קיבוליים, במיוחד כאשר עובי שכבת השומן התת עורית עולה על~1 ס"מ. לפיכך, הנחיות אבטחת האיכות האירופיות ממליצות על שימוש במכשירי מערך מדורג קרינתיים עבור חולים בעולם המערבי. מתן טיפול בהיפרתרמיה דורש ניטור טמפרטורה בזמן אמת והתאמה בזמן אמת של הגדרות המערכת בתגובה לטמפרטורות נמוכות של הגידול או לתלונות המטופלים כאשר מתרחשות נקודות חמות המגבילות טיפול ברקמות תקינות. ניטור טמפרטורה מידי מתבצע באמצעות בדיקות טמפרטורה זעירות פולשניות, המוחדרות בדרך כלל לשלפוחית השתן, לנרתיק/צוואר הרחם ולפי הטבעת. היישום של תרמומטרית MRI לא פולשנית נמצא בפיתוח לטיפול בגידולי אגן עמוקים, אך גודל המטופל וממצאי התנועה הם כיום גורמים מגבילים ליישומה ולדיוקו. חימום מקומי-אזורי מסמן שגם טמפרטורות באיברים שכנים, כגון שלפוחית השתן והרקטום, גם כן עולים לרמות גבוהות; זה נחשב למקובל מכיוון שהרדיוסנסיטיזציה ההיפרתרמית היא סלקטיבית לגידול, וזאת בתנאי שהטמפרטורות אינן עולות על 44-45 מעלות צלזיוס. תכנון הטיפול משמש כיום במרכזים אקדמיים נבחרים שבהם תכנון הסתגלותי בזמן אמת (מקוון) הוא אמין מבחינה כמותית.
Patient workflow –
תזרים העבודה למתן טיפול בהיפרתרמיה מקומית-אזורית (locoregional) כולל מספר שלבים. ראשית, היפרתרמיה צריכה להיות מתוכננת ברצף עם מתן הקרנות. באופן כללי, היפרתרמיה ניתנת פעם בשבוע זמן קצר לפני או אחרי פרקציות ההקרנות. במקרים חריגים מסוימים, היפרתרמיה ניתנת פעמיים בשבוע, עם לפחות 3 ימים בין כל מפגש כדי למנוע אינדוקציה של עמידות תרמית. כדי להשיג את התועלת המרבית של היפרתרמיה כרדיוסנסטיזטור, מרווח הזמן בין הקרנות להיפרתרמיה צריך להיות פחות משעה אחת. במרכז של החוקרים, לאחר מיקום של צנתרים פולשניים מינימליים להחדרת בדיקות טמפרטורה בנרתיק, בשלפוחית השתן ובפי הטבעת, נעשה CT תכנון היפרתרמיה (hyperthermia planning CT) של המטופלת על מזרן ההיפרתרמיה ובולוס המים מסביב עם צנתרי הבדיקה התרמית האלה במקומם (איור 2A). CT זה משמש לחלוקה אוטומטית של רקמות בעלי תכולת מים גבוהה לעומת אלו עם תכולת מים נמוכה עבור תכנון טיפול בהיפרתרמיה, כאשר הגידול מותאם על ידי הרופא, בהנחיית ה-MRI שנעשה לתכנון הקרנות (איור 2B). בנוסף, ה-CT משמש לקביעת אילו מנקודות מדידת הטמפרטורה מייצגות גידול ואילו רקמה נורמלית לבקרת טמפרטורה אופטימלית במהלך הטיפול. מטרת תכנון הטיפול בהיפרתרמיה היא לקבוע את הגדרות המכשיר האופטימליות וכתוצאה מכך חימום טוב של הגידול תוך הימנעות מחימום יתר של רקמות רגילות (איור 2A).
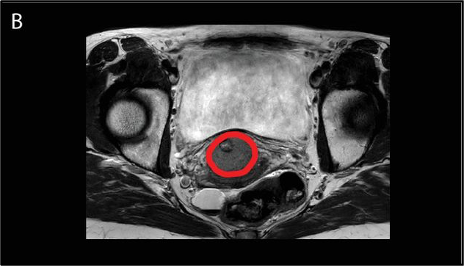
להלן איור A2: תכנון טיפול היפרתרמיה כאשר הגידול בצוואר הרחם מתואר באדום בסריקת CT היפרתרמיה ייעודית עם בדיקות תרמיות במקום שנעשו ישירות לפני טיפול ההיפרתרמיה. מוצגות גם הנקודות החמות (האזור האדום) והקרות (האזור הירוק).
להלן איור B2: סריקת MRI כסיוע לקווי מתאר המתאימים של הגידול ב-CT
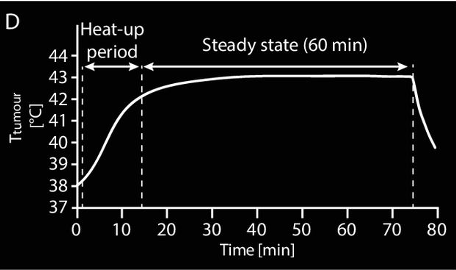
לאחר CT, החולה מועבר למתקן להיפרתרמיה העמוקה של החוקרים והטיפול מתחיל. בדיקות טמפרטורה מרובות חיישנים מוכנסות לתוך הבדיקות התרמיות בנרתיק, בשלפוחית השתן ובפי הטבעת. המטופל שוכב על מזרן עם ארבע אנטנות הממוקמות סביב נפח המטרה (איור 3). על מנת למנוע כוויות בעור, בולוסים של מים לקירור ממוקמים בין האנטנות לבין העור של המטופל. לאחר מכן, המטופל ממוקם במערכת כאשר הגידול במרכז טבעת האנטנה, בהתבסס על מיקום הגידול ב- CT. ניטור טמפרטורה פולשני-זעיר שנעשה על ידי בדיקות טמפרטורה בצוואר הרחם, בשלפוחית השתן ובפי הטבעת הוא חובה, וניתן במקרים נבחרים להשלים אותו עם תרמומטריה לא פולשנית מבוססת MRI בעת שימוש במערכת היפרתרמיה היברידית מקומית-אזורית. המתח מופעל ותקופת החימום מתחילה (~15-30 דקות) (איור 2C,D). כאשר מגיעים לטמפרטורת גידול של 41 מעלות צלזיוס, מתחיל פרק הזמן של המצב היציב למשך שעה אחת (איור 2C, D). המפעילים עוקבים באופן רציף אחר קריאות הטמפרטורה ואחר הערות המטופלים במהלך הטיפול, ומייעלים מחדש את הגדרות המכשיר בעת הצורך, בתגובה לטמפרטורות גידול לא אופטימליות, לנקודות חמות מגבילות-טיפול או למטופלים שמרגישים יתר אי-נוחות. ניטור מתמשך זה בזמן אמת ואופטימיזציה מחדש, המונחה גם על ידי תכנון טיפול היפרתרמיה אדפטיבי, מניב טמפרטורות גידול אופטימליות. עם זאת, כדי להיות כשיר לספק טיפול היפרתרמיה באיכות כה גבוהה, צוות מנוסה ומיומן היטב הינו חיוני בכדי להגיע לאפקט הרדיוסנסיטיזציה התרמית האופטימלי. מינון תרמי גבוה יותר יכול להיות מושג הן על ידי הגדלת הטמפרטורה או על ידי הארכת זמן הטיפול, שבו טיפול היפרתרמיה מקומית של שעה אחת נחשב, למקסימום שהמטופלים יכולים לסבול.
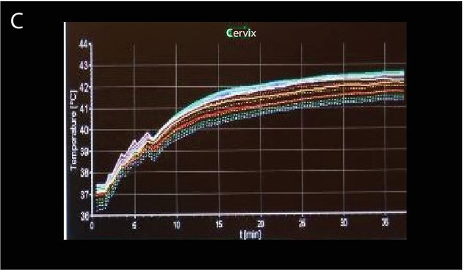
להלן איור C2: פרופיל טמפרטורה אמיתי של הגידול המכיל קריאות טמפרטורה של אזור המטרה והאזורים הסובבים אותו במהלך הטיפול.
להלן איור D2: פרופיל טמפרטורת הגידול מפושט במהלך הטיפול.
להלן איור 3: מכשיר קרינה של היפרתרמיה מקומית-אזורית: הדוגמה המוצגת כאן היא מערכת ALBA4D בעלת ארבע אנטנות.
תוצאות קליניות בקרצינומה של צוואר הרחם:
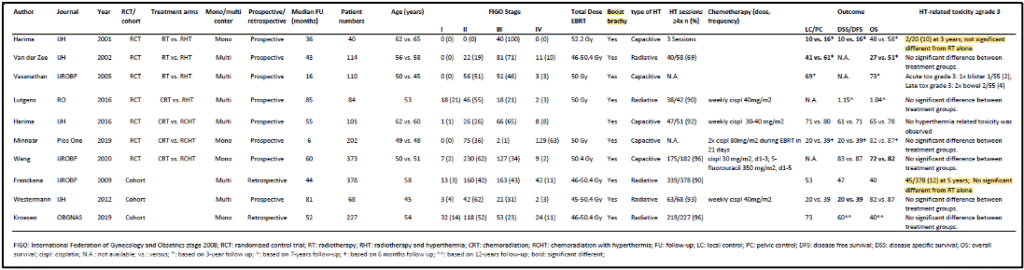
בכדי לקבל סקירה כללית של התוצאות הקליניות של היפרתרמיה בטיפול בסרטן צוואר הרחם, ערכו החוקרים חיפוש שיטתי ב-PubMed, כמתואר לעיל באסטרטגיית החיפוש וקריטריוני הבחירה. בסך הכל זוהו 365 עבודות; מאמרים כפולים ושאינם באנגלית לא נכללו. לאחר סינון על ידי שני סוקרים, נכללו 42 מאמרים להערכה מלאה על סמך הכותרת והתקציר. לבסוף, 10 מאמרים עמדו בקריטריוני ההכללה ויידונו בהמשך. מבין המאמרים הללו, שבעה היו ניסויים אקראיים מבוקרים ושלושה היו מחקרי עוקבה. מאפייני המטופלים והטיפול הכלליים הראו כי רוב החולים חלו בסרטן צוואר הרחם בשלב II או III לפי international Federation of Gynaecology and Obstetrics (FIGO). היוצא מן הכלל היחיד היה במחקר של Minnaar ואח', שבו רוב החולים סבלו ממחלה בשלב IVA לפי FIGO. כל החולים טופלו בהקרנות חיצוניות (external beam radiotherapy) במינון כולל של 45-50.4 Gy ב-25-28 פרקציות, ולאחר מכן במנת חיזוק (brachytherapy boost) בברכיתרפיה. חולים שקיבלו כימותרפיה קיבלו בדרך כלל ציספלטין שבועי במינון של 40 מ"ג/מ"ר. רוב החולים שטופלו בהיפרתרמיה עברו לפחות ארבע מפגשי היפרתרמיה. מתוך ניסויי הביקורת האקראיים, שלושה מחקרים השוו בין הקרנות לבין הקרנות בשילוב עם היפרתרמיה (תרמו-רדיותרפיה), מחקר אחד השווה כימורדיותרפיה עם תרמו-רדיותרפיה, ושלושה מחקרים השוו כימורדיותרפיה עם כימורדיותרפיה בשילוב עם היפרתרמיה (טבלה 1).
המחקרים הישנים יותר, לפני כניסתו של ציספלטין כסנסטיזטור, השוו הקרנות עם תרמו-רדיותרפיה. בשנת 2000 פורסמו תוצאות ניסוי ההיפרתרמיה העמוקה של Dutch Deep Hyperthermia trial. ניסוי אקראי, רב-מרכזי זה בחן את ההשפעה על תגובה מלאה ושליטה מקומית מתמשכת של הקרנות לעומת טיפולי הקרנות עם היפרתרמיה ב-358 חולים עם גידולי אגן (סרטן שלפוחית השתן, פי הטבעת וצוואר הרחם). הניסוי הראה שיעור תגובה מלאה גבוה יותר באופן משמעותי ושליטה מקומית טובה יותר בחולים שטופלו בשילוב של הקרנות והיפרתרמיה לעומת טיפולי הקרנות בלבד. עם זאת, נראה היה כי ההשפעה החזקה ביותר נצפתה בחולים עם סרטן צוואר הרחם. לכן, בוצעה תת-אנליזה בקבוצת סרטן צוואר הרחם ופורסמה שנתיים לאחר מכן. בתת-קבוצה זו, שיעור השליטה המקומית ל-3 שנים היה 61% לעומת 41%, וההישרדות הכוללת הייתה 51% לעומת 27%, בהתאמה, לטובת קבוצת התרמו-רדיותרפיה. יש לציין כי רוב החולים (62%) סבלו ממחלת FIGO בשלב III (43). הטיפול המשולב נסבל היטב ולא נצפתה רעילות נוספת הקשורה להיפרתרמיה בקבוצת התרמו-רדיותרפיה.
להלן טבלה 1: סיכום של מאפייני החולים והטיפול ותוצאות הטיפול של הניסויים האקראיים המבוקרים הכלולים. נותני התוצאה מבוטאים ב5 שנים, אלא אם כן צוין אחרת.
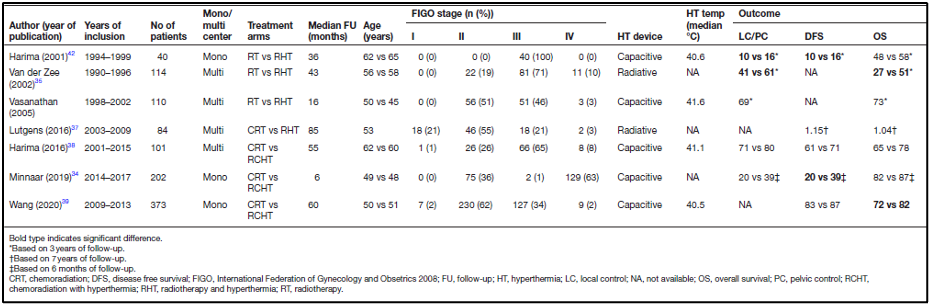
ניסוי אקראי נוסף, עם 40 מטופלים הראה גם הוא, שיעור תגובה מלאה טוב יותר באופן משמעותי (80% לעומת 50%) בקבוצת התרמו-רדיותרפיה לעומת קבוצת ההקרנות בלבד. בנוסף, הוצגה מגמה של הישרדות טובה יותר ללא מחלה (64% לעומת 45%) ולהישרדות כוללת (58% לעומת 48%) בקבוצת התרמו-רדיותרפיה. עם זאת, הבדל זה לא היה מובהק סטטיסטית, כנראה בשל גודל המדגם הקטן. מחקר של Vasanthan ואח', שפורסם בשנת 2005, לא הראה שום תועלת בטיפול בתרמו-רדיותרפיה לעומת טיפול בהקרנות בלבד. במחקר זה, גם לא נצפה הבדל משמעותי ברעילות אקוטית חמורה (דרגה 3) וברעילות מאוחרת. הערה על מחקר רב-מרכזי זה הייתה שכן הטכניקות שייושמו בהיפרתרמיה היו לא תואמות כמו כן גם הבטחת האיכות, וכי הטמפרטורות המדווחות העריכו יתר על המידה את טמפרטורת הגידול שהושגה.
שלושה ניסויים אקראיים שהשוו בין רדיותרפיה לתרמו-רדיותרפיה לא נמצאו על ידי החיפוש של החוקרים מכיוון שהתוצאות פורסמו בכתבי עת שאינם באנגלית. למרות זאת, נתונים ממחקרים אלה נכללו בסקירה של Cochrane לגבי השימוש המשולב בהיפרתרמיה והקרנות בחולות סרטן צוואר הרחם מקומי מתקדם. סקירה זו כללה שישה מחקרים אקראיים שפורסמו בין השנים 1987 ל-2009, והראתה תוצאות טובות יותר עם תוספת של היפרתרמיה לטיפול בהקרנות. ניתוח נתונים מרוכזים הראה שיעור תגובה מקומית גבוה יותר באופן משמעותי, ושליטה מקומית טובה יותר במשך 3 שנים והישרדות כוללת. לא נצפו הבדלים ברעילות אקוטית וברעילות מאוחרת חמורה. יש לציין כי 74% מהחולים שנכללו סבלו ממחלה בשלב III של FIGO.
רק ניסוי אקראי אחד השווה בין כימורדיותרפיה לתרמו-רדיותרפיה בנשים עם סרטן צוואר הרחם גדול (bulky) ו/או שלב FIGO ≥ III. מחקר זה נסגר בטרם עת בשל חוסר איסוף. בסך הכל גויסו 84 מטופלים. לא נמצאו הבדלים משמעותיים בהישרדות ללא מחלה ובהישרדות הכוללת בין שתי זרועות הטיפול. למרות שהמחקר נסגר בטרם עת, תוצאות אלה מצביעות על כך שתרמו-רדיותרפיה מניבה תוצאות קליניות דומות לתוצאות של כימורדיותרפיה בטיפול בסרטן צוואר הרחם מקומי מתקדם.
לאחרונה פורסמו תוצאות של שלושה ניסויים אקראיים מבוקרים שהשוו בין כימורדיותרפיה לכימורדיותרפיה בשילוב עם היפרתרמיה. המחקר הראשון של Harima ואח' (2016) תיאר את התוצאות של מחקר רב-מרכזי בהשתתפות של 101 חולים. למרות שלא נצפו הבדלים משמעותיים בהישרדות ללא מחלה, בהישרדות הכוללת או בתגובה המלאה, זרוע הטיפול המשולש הציגה ביצועים טובים יותר באופן עקבי מזרוע הכימורדיותרפיה עם רווח של כל פרמטרי התוצאה של כ-10%. גודל המדגם הקטן יחסית בשילוב עם העובדה שחלק מהחולים קיבלו מינון היפרתרמיה תת-אופטימלי נמוך, ככל הנראה מסביר את ההבדל הלא מובהק. אנליזה מפורטת יותר על ידי Ohguri ואח', (2018) הדגימה כי הישרדות ללא מחלה למשך 5 שנים הייתה 81% עבור חולים בהם הושג מינון תרמי גבוה (CEM43T90 ≥1 דקות) לעומת 61% עבור חולים שקיבלו כימורדיותרפיה בלבד (p=0.036).
ניסוי אקראי מבוקר גדול בהרבה בהשתתפות של 435 מטופלים, הציג הישרדות כללית טובה יותר באופן משמעותי בזרוע הטיפול המשולש; ההישרדות הכוללת במשך 5 שנים הייתה 82% ו-72% עבור כימורדיותרפיה בשילוב היפרתרמיה וכימורדיותרפיה בלבד, בהתאמה. ההבדל בהישרדות ללא הישנות לא היה שונה באופן משמעותי. שוב, לא נראה הבדל ברעילות אקוטית ומאוחרת. לבסוף, Minnaar ואח', (2019) פרסמו את התוצאות הראשוניות של הניסוי האקראי שלהם שבו נכללו 271 חולים. הם הראו יתרון משמעותי של הוספת היפרתרמיה כימורדיותרפיה באשר להישרדות ללא מחלה, אך לא להישרדותה כוללת. ייתכן שהסיבה לכך היא תקופת המעקב החציונית הקצרה של 6 חודשים. יש לציין כי תוצאות זרוע הכימורדיותרפיה במחקר זה נראות גרועות מהצפוי על פי הסטנדרטים הנוכחיים. הסיבה לכך היא ככל הנראה שהמחקר מדווח על תוצאות הטיפול בסרטן צוואר הרחם בחולות בשלבים מתקדמים עם מצב בריאותי ירוד יחסית, במדינה בעלת הכנסה נמוכה עם משאבים מוגבלים לטיפול בחולות על פי הסטנדרטים המומלצים ביותר עם טיפול בהקרנות חיצוניות בשילוב עם כימותרפיה, ולאחר מכן חיזוק (boost) ברכיתרפיה.
מטא-אנליזה שנערכה לאחרונה הגיעה למסקנה כי קיים יתרון משמעותי בהוספת היפרתרמיה לכימורדיותרפיה המשפיע על ההישרדות הכוללת, אך לא על הישרדות מקומית ללא הישנות. באופן מרגיע, לא נצפתה עלייה ברעילות עם תוספת של היפרתרמיה. במחקרים שהוזכרו קודם לפני על כימורדיותרפיה בשילוב עם היפרתרמיה, כולם השתמשו במכשיר היפרתרמיה קיבולי שקל יותר לשימוש, עם זאת, עם התמחור שהופך למאתגר יותר להשיג את רמות טמפרטורת הרצויות בגידול. הרלוונטיות של מינון תרמי אופטימלי, אומתה על ידי ניתוח-מחדש של המחקר שהוזכר לעיל על ידי Harima ואח'(2001).
Ohguri ואח'. (2018) מצאו כי הישרדות ללא מחלה הייתה טובה יותר רק בחולים בהם הושג מינון תרמי גבוה יותר (CEM43T90 >1 דקות) בהשוואה לחולים שקיבלו כימורדיותרפיה בלבד. למרות שטיפול הכימורדיותרפיה המשולשת בשילוב עם טיפול בהיפרתרמיה עשויה להיות בעלת ערך נוסף על פני כימורדיותרפיה, היא אינה נחשבת כיום כטיפול סטנדרטי בטיפול בסרטן צוואר הרחם מקומי מתקדם. באופן מעניין, ניתוח רשת שנערך לאחרונה זיהה כי הקרנות והיפרתרמיה, כימורדיותרפיה עם היפרתרמיה, וכימורדיותרפיה עם ציספלטין 3 פעמים מידי שבוע, כשיטות הטיפול הטובות ביותר לטיפול בסרטן צוואר הרחם מקומי מתקדם, תוך עמידה מקיפה בנקודות קצה מרכזיות-קליניות בנוגע לבקרת הגידולים, הישרדות ותחלואה. למרות זאת, זה צריך להיות כפוף למחקר נוסף מכיוון שמשטר הכימותרפיה הנוכחי הסטנדרטי הוא עם ציספלטין שבועי במינון של 40 מ"ג/מ"ר.
התוצאות של שלושת מחקרי העוקבה הכלולים בסקירה הנוכחית מסוכמות בטבלה 2. שני מחקרי עוקבה היו רטרוספקטיביים באופיים, בעוד שמחקר אחד היה פרוספקטיבי. Franckena ואח'. (2009) חקרו את הקשר בין פרמטרים של מינון תרמי לבין תוצאות מחלה ספציפיות להישרדות, שליטה באגן ושיעור תגובה מלאה. הם הראו כי שני פרמטרים שונים של מינון תרמי, שניהם משקפים את טמפרטורת הגידול החציונית ואת משך החימום, TRISE (p=0.002 להישרדות ספציפית למחלה; p=0.021 לשליטה באגן; וp=0.027 לתגובה מלאה), ו-CEM43T90 (p=0.001 להישרדות ספציפית למחלה; p=0.019 לשליטה באגן; ו p=0.195 לתגובה מלאה) היו גורמים פרוגנוסטיים בלתי-תלויים לבקרת הגידול. הקשר בין המינון התרמי החציוני לתוצאה אושש במחקר מאוחר יותר של Kroesen ואח'. הם הראו כי למינון תרמי הייתה השפעה מועילה גם על השליטה המקומית בחולים שטופלו על פי הסטנדרטים הנוכחיים עם טיפול בקרינה חיצונית ואחריו ברכיתרפיה מונחה על ידי MRI.
להלן טבלה 2: סיכום של מאפייני החולים והטיפול ותוצאות הטיפול של מחקרי העוקבה הכלולים. נתוני התוצאה מבוטאים ב-5 שנים, אלא אם כן צוין אחרת.
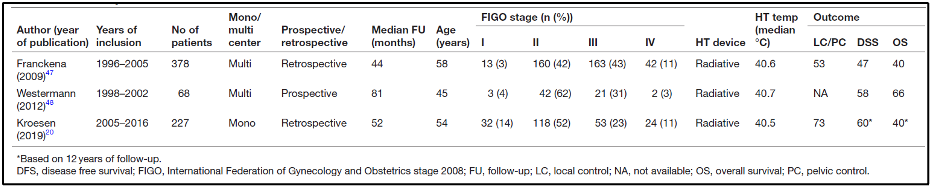
לבסוף, Westermann ואח'. (2012) פרסמו את התוצאות ארוכות הטווח של הטיפול המשולש (כימורדיותרפיה עם היפרתרמיה) בחולות עם סרטן צוואר הרחם מקומי מתקדם, והגיעו למסקנה כי שילוב זה של טיפול הוא בר-ביצוע, נסבל היטב, ובר השוואה עם התוצאות של ניסויים אקראיים של אותה תקופה. עם זאת, מכיוון שמדובר היה במחקר לא אקראי, לא ניתן היה להסיק מסקנות נוספות. טיפול בקרבופלטין (Carboplatin) כמונותרפיה מוצע לעתים קרובות כרדיוסנסטיזטור חלופי לציספלטין בטיפול בסרטן צוואר הרחם מקומי מתקדם, למרות שאין ראיות לכך שזה עובד היטב באותה המידה. יתרה מכך, לא נערכו או תוכננו ניסויים קליניים המשווים היפרתרמיה והקרנות עם קרבופלטין והקרנות. עם זאת, כמה מחקרים קליניים קטנים בדקו את ההשפעה של שילוב טיפול בקרבופלטין (Carboplatin) כמונותרפיה עם היפרתרמיה והקרנות. מחקר אחד בשלב 1 השתמש בשילוב של הקרנות, היפרתרמיה וקרבופלטין תוך-עורקי ב-15 חולות סרטן צוואר הרחם עם הישנות מקומית. למרות שמשטר זה נסבל היטב, התוצאות היו מאכזבות. מחקר נוסף בשלב 2 העריך את ההשפעה של היפרתרמיה ככל-גופית, בשילוב עם קרבופלטין ב-25 חולות עם הישנות של סרטן צוואר הרחם או סרטן גרורתי. נצפתה רעילות ניכרת והתוצאות היו דומות לכימותרפיה בלבד, ולכן משטר טיפול זה נחשב פחות מתאים בחולים פליאטיביים אלה.
מחקרים מסוימים דיווחו רק על רמת הטמפרטורה המיועדת, ללא מדידת טמפרטורות על מנת לוודא אם טמפרטורת המטרה אכן הושגה. ייתכן שגם העובדה שנעשה שימוש בשני סוגים שונים של מערכות היפרתרמיה (קיבוליות וקרינה) עשויה הייתה אף היא להשפיע על התוצאה, מכיוון שהשגת הטמפרטורה הממוקדת מאתגרת יותר עבור מכשירים קיבוליים. כל המחקרים שנכללו באירופה השתמשו במערכות היפרתרמיה קרינתיות, בעוד שמחקרים רבים שאינם אירופיים השתמשו במערכות היפרתרמיה קיבוליות.
מתן טיפול טוב בהיפרתרמיה דורש צוות של אנשי מקצוע מיומנים ומנוסים, פרוטוקולי טיפול ייעודיים, מכשירי היפרתרמיה אמינים, תכנון טיפול ואבטחת איכות. היעדרם של אלה היווה גורם לכישלון בחלק מהניסויים הקליניים ומכשול לשימוש קליני רחב יותר בהיפרתרמיה. בעשור האחרון השתפרו מערכות ההיפרתרמיה ופותחו קווים מנחים. למרבה המזל, כלים אמינים לתכנון טיפול המאפשרים תכנון הסתגלותי בזמן אמת הופכים לזמינים. קבוצה של מרכזים אירופיים מפתחת מחקרי רישום פרוספקטיביים רב-מרכזיים עם אבטחת איכות מתוכננת היטב ודיווח נתונים עבור מספר אתרי גידול במסגרת פרויקט 'Hyperboost' (www.hyperboost.eu) האירופי H2020. פיתוחים אלה יסייעו למשתמשים חדשים לאמץ וליישם היפרתרמיה קלינית בקלות רבה יותר.
במחקרים שנכללו, הרעילות דורגה באופן כללי על פי קריטריוני הרעילות לתופעות לוואי. למרות שלא נצפתה רעילות חמורה נוספת בניסויי ההיפרתרמיה, היפרתרמיה עלולה להוביל לרעילות אקוטית ומאוחרת במקרים מסוימים. בייחוד, כוויות תרמיות ונמק שומני נחשבים לרעילות הקשורה בהיפרתרמיה, והם יכולים להיות מועקה בעבור המטופלים. בנוסף, ניתן להבחין במיופתיות (myopathies) ובאי נוחות של המטופל במהלך וזמן קצר לאחר הטיפול בהיפרתרמיה. עם זאת, ניתן לצמצם את הסיכונים של רעילות הקשורה להיפרתרמיה כאשר מקפידים על פרוטוקולים טובים לאבטחת האיכות. למרות שמדדי התוצאה המדווחים כיום על ידי המטופלים משמשים לעתים קרובות בכדי להעריך את נטל הטיפול על איכות החיים, אף אחד ממדדי התוצאה שדווחו על ידי מטופלים לא הוערכו בניסויי ההיפרתרמיה שהוזכרו קודם לכן. דעת המומחים היא כי תרמו-רדיותרפיה נסבלת יותר כימורדיותרפיה ולכן ניתן להציע אותה לחולים שבירים שאינם מתאימים לטיפול בכימותרפיה. החולים האופייניים המופנים להיפרתרמיה הם אלה שיש להם התוויות נגד ציספלטין. אלה כוללים נשים עם תפקוד כלייתי ירוד ואובדן שמיעה, אך גם קשישים וחולים תשושים. בנוסף, חולים המסרבים לכימותרפיה יכולים גם להיות מופנים לטיפול בהיפרתרמיה. התוויות הנגד היחידות להיפרתרמיה עמוקה הן תותבות מתכת בירך וקוצבי לב, מה שהופך את הטיפול הזה בשילוב עם הקרנות מתאים עבור רוב החולים עם סרטן צוואר הרחם מקומי מתקדם.
פרספקטיביות לעתיד ומסקנות:
מכשירים קרינתיים של היפרתרמיה מקומית-אזורית (Radiative locoregional hyperthermia) הינם האופטימליים כיום להשגת טמפרטורות טיפוליות בגידולים עמוקים, כגון בסרטן צוואר הרחם. גישה חדשנית המבוססת על אינדוקציה של היפרתרמיה על ידי סריקת קרן אולטרסאונד ממוקדת בעוצמה גבוהה (high-intensity focused ultrasound beam) דרך נפח הגידול נמצאת בשלבי פיתוח, אך יש צורך לבדוק את השימוש בה בבני אדם. אספקת היפרתרמיה אמינה דורשת גם ניטור טמפרטורה בזמן אמת באמצעות בדיקות טמפרטורה זעירות-פולשניות המוחדרות לנרתיק/צוואר הרחם, לשלפוחית השתן ולפי הטבעת. תרמומטריה בלתי-פולשנית מבוססת MRI נמצאת בשלבי פיתוח, אך הדיוק שלה עדיין מוגבל מאוד על ידי ממצאי תנועה (motion artifacts), וכמחצית מהמטופלים אינם מתאימים לבור הקטן של מכשיר ההיפרתרמיה המקומית-אזורית ההיברידית מונחה MRI.
תכנון מוקדם של הטיפול הוא כלי רב ערך נוסף למיטוב מתן הטיפול. תכנון הטיפול כיום אמין מבחינה איכותית ומסוגל לקבוע הגדרות מערכת המכוונות באופן אמין לגידול. תכנון הסתגלותי מקוון בזמן אמת במהלך הטיפול הוא המפתח לאופטימיזציה מחדש של הגדרות במהלך טיפול בהיפרתרמיה לטמפרטורות אופטימליות של הגידול ודיכוי של הופעת פוטנציאל המגביל טיפול כגון נקודות חמות של רקמות נורמליות. תוכנה מסחרית לתכנון טיפול אדפטיבי נמצאת בפיתוח, כולל VEDO ו-Plan2Heat, המאפשרות תכנון ניתוב בזמן אמת במהלך הטיפול. כלים אלה מאפשרים למשתמשי היפרתרמיה מתחילים להשיג במהירות שליטה טובה בטיפול. אימונותרפיה בשילוב עם כימותרפיה והקרנות נחקרת יותר ויותר בניסויים בסרטן צוואר הרחם, ונחקרה במיוחד בסרטן צוואר הרחם בסיכון גבוה, מקומי-מתקדם וגרורתי. למרות שהטיפול באימונותרפיה עשוי להיות בעל השפעה סינרגטית בשילוב עם היפרתרמיה, עד כה לא בוצעו או תוכננו מחקרים קליניים המשלבים אימונותרפיה עם היפרתרמיה והקרנות.
לסיכום, ציספלטין בשילוב עם רדיותרפיה הוא הטיפול הסטנדרטי כיום בעבור חולות עם סרטן צוואר הרחם מקומי מתקדם. עם זאת, תרמו-רדיותרפיה היא החלופה הטובה ביותר המבוססת ראיות, נסבל היטבת ויש להציעה לכל החולים עם התוויות נגד ציספלטין.
להלן נספח 1: סקירה מלאה של המטופלים ומאפייני הטיפול ותוצאות הטיפול של המחקרים הכלולים.