Intensity-Modulated Radiotherapy with Regional Hyperthermia for High-Risk Localized Prostate Carcinoma
Cancers (Basel), 2022 Jan, vol. 14,2, 400
Sota Nakahara1, Takayuki Ohguri1, Sho Kakinouchi1, Hirohide Itamura1, Takahiro Morisaki1, Subaru Tani1, Katuya Yahara2 and Naohiro Fujimoto3
- Department of Therapeutic Radiology, University Hospital of Occupational and Environmental Health, Kitakyushu 807-8555, Japan.
Department o - Radiotherapy, Kurashiki Medical Center, Kurashiki 710-8522, Japan.
Department of Urology - University of Occupational and Environmental Health, Kitakyushu 807-8555, Japan
טיפול בקרינה מייננת בעלת עוצמה מאופננת יחד עם היפרתרמיה אזורית עבור קרצינומה מקומית של הערמונית בסיכון גבוה
תקציר
מספר מחקרים אקראיים ומבוקרים הדגימו כי שימוש במקביל בהיפרתרמיה אזורית עמוקה (deep regional hyperthermia) ובטיפולי הקרנות, מביא לעלייה משמעותית בשליטה המקומית (local control) בסרטן צוואר הרחם ובסרטן הרקטום. קרינה מייננת בעלת עוצמה מאופננת (Intensity-modulated radiotherapy) בתוספת של טיפול להפחתת אנדרוגן (androgen deprivation therapy) הפכה לאחרונה לטיפול סטנדרטי עבור קרצינומה מקומית של הערמונית בסיכון גבוה (high-risk localized prostate carcinoma); עם זאת, מכיוון שיש מקום לשיפור בתוצאות, החוקרים השתמשו בהיפרתרמיה על מנת לשפר את ההשפעה של הטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT). אנליזה רטרוספקטיבית זאת מדגימה כי הוספה של היפרתרמיה אזורית לטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) בתוספת טיפול להפחתת אנדרוגן (ADT) היא גישה מבטיחה מכיוון שהיא משפרת את התוצאות הקליניות (clinical outcomes) עם רעילות מקובלת. חשוב לציין כי מינון תרמי (thermal dose) גבוה יותר נמצא בקורלציה משמעותית עם הישרדות ביוכימית טובה יותר ללא מחלות (biochemical disease-free survival). יש צורך במחקרים נוספים, לרבות ניסויים פרוספקטיביים עם פרוטוקולי טיפול מפורטים.
רקע – מטרת מחקר זה הייתה להעריך את היעילות והרעילות של הוספת היפרתרמיה אזורית לטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) יחד עם טיפול להפחתת אנדרוגן (ADT) ניאו-אדג'ובנטי עבור קרצינומה מקומית של הערמונית בסיכון גבוה.
שיטות – נתונים מ-121 מטופלים עוקבים עם קרצינומה של הערמונית בסיכון גבוה, שטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) נותחו באופן רטרוספקטיבי. המינון הכולל המתוכנן של הטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) היה 76 Gy ב-38 מקטעים עבור כל המטופלים; היפרתרמיה יושמה אצל 70 מתוך 121 מטופלים. טמפרטורות תוך-רקטליות (Intra-rectal) בגובה הערמונית נמדדו בכדי להעריך את המינון התרמי.
תוצאות – המספר החציוני של מפגשי טיפול החימום היה חמש והמינון התרמי הכולל החציוני של CEM43T90 היה 7.5 דקות. משך המעקב החציוני עמד על 64 חודשים. התוספת של היפרתרמיה לטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) ניבאה הישרדות קלינית טובה יותר ללא הישנות (clinical relapse-free survival). מינון תרמי גבוה יותר עם CEM43T90 (מעל ל-7 דקות) ניבא הישרדות ביוכימית טובה יותר ללא מחלות. ההיארעות של רעילות אקוטית ומאוחרת ≥ לדרגה 2, לא הייתה שונה באופן מובהק בין מטופלים עם היפרתרמיה או ללא היפרתרמיה.
מסקנות – טיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) בתוספת של היפרתרמיה אזורית, מייצגת גישה מבטיחה עם רעילות מקובלת עבור קרצינומה מקומית של הערמונית בסיכון גבוה. נדרשים מחקרים נוספים על מנת לאמת את היעילות של טיפול משולב זה.
מבוא
טיפול בקרינה עם טיפול להפחתת אנדרוגן (ADT) הוא שיטת הטיפול העיקרית בעבור מטופלים עם סרטן ערמונית מקומי בסיכון גבוה (localized prostate cancer). קרינה חיצונית, כגון קרינה מייננת בעלת עוצמה מאופננת (IMRT), טיפול בקרינה סטארוטקטית לגוף (stereotactic body radiation) וטיפול בפרוטונים (proton therapy), נמצאת בשימוש גבוה יותר בשנים האחרונות על מנת לייעל את ריכוז המינון בגידולים ולהפחית את החשיפה לאיברים בסיכון (at-risk organs). ההישרדות הביוכימית ללא מחלות למשך 5 שנים עבור הטיפול בקרינה חיצונית (external beam radiotherapy) דווחה כ-80-90% בקבוצת הסיכון הנמוך, 70-80% בקבוצת הסיכון הבינוני ו-50-70% בקבוצת הסיכון הגבוה. ניתן לשפר את התוצאות הקליניות בקבוצת הסיכון הגבוה, בניגוד לקבוצות בסיכון הנמוך עד הבינוני.
היפרתרמיה ידועה כציטוטוקסית לתאים סרטניים ופועלת כרדיוסנסיטייזר (radiosensitizer). תאי גידול העמידים לטיפול בהקרנות (Radiation therapy-resistant) הינים היפוקסיים, בעלי pH נמוך, עם מחסור בנוטריינטים ובשלב ה-S הינם רגישים יותר להיפרתרמיה. היעילות הקלינית של טיפול בהקרנות יחד עם שילוב של היפרתרמיה הודגמה במחקרים קליניים אקראיים בחולים עם סרטן מתקדם של הראש והצוואר, הישנות מקומית של סרטן השד, מלנומה ממאירה, סרטן שלפוחית השתן, סרטן פי הטבעת וסרטן צוואר הרחם. בחולים עם סרטן הערמונית, ניסויים קליניים בפאזה 1 או 2 ומחקרים רטרוספקטיביים קודמים, תיארו את השימוש בטיפול בקרינה קונפורמלית תלת ממדית (three-dimensional conformal radiation) בשילוב עם היפרתרמיה אזורית כמבטיח והן בר ביצוע. בנוסף, הוא אינו גורם לרעילות חמורה.
ביפן, הבטיחות והיעילות של היפרתרמיה בשילוב עם טיפול בהקרנות באמצעות המכשיר הקיבולי (capacitive device) 8-MHz הודגמו מאז שנות השמונים, כולל במחקרי פאזה 1 או 2 פרוספקטיביים של חולים עם גידולי אגן ממאירים עמוקים (deep-seated malignant pelvic tumors). בהתבסס על תוצאות אלה, ומאז שנות התשעים, היפרתרמיה אלקטרומגנטית (electromagnetic hyperthermia) לגידולים ממאירים מכוסה על ידי ביטוח הבריאות הציבורי, ללא קשר לסוג ולשלב הגידול הממאיר. ביפן, כל האנשים מכוסים על ידי ביטוח בריאות ציבורי. המטופל רשאי לבחור את המוסד הרפואי ויכול לקבל טיפול רפואי מתקדם בעלות נמוכה. בפרקטיקה הקלינית, היפרתרמיה אלקטרומגנטית משמשת בעיקר לסוגי סרטן מקומיים מתקדמים, כאשר נדרש בהם שיפור נוסף של ההשפעות האנטי-סרטניות של טיפולי ההקרנות ו/או כימותרפיה, אם כי רק מספר מצומצם של בתי חולים מסוגלים לבצע את ההליך. לפיכך, במוסד של החוקרים, טיפול משולב באמצעות קרינה מייננת בעלת עוצמה מאופננת (IMRT) והיפרתרמיה אזורית החל בשנת 2011, על מנת לשפר את התוצאות הקליניות במטופלים עם סרטן ערמונית מקומי בסיכון גבוה. למיטב ידיעת החוקרים, לא קיימים דיווחים על התוצאות הקליניות לאחר טיפול משולב שכזה; לפיכך, מטרת מחקר זה הייתה להעריך את היעילות והרעילות של טיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) בתוספת של היפרתרמיה אזורית עבור קרצינומה מקומית של הערמונית בסיכון גבוה.
חומרים ושיטות
מטופלים
במחקר הנוכחי, החוקרים הסבירו למטופלים כי הטיפול הסטנדרטי בסרטן הערמונית בסיכון גבוה, עבור ארגון חקר הסרטן העולמי (National Comprehensive Carcinoma Network) בשילוב של טיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) וטיפול הורמונלי מביא להישנות ביוכימית (biochemical recurrence) בכ-20-40% מהמטופלים, ובכך מצריך טיפול נוסף. יתר על כן, האפשרות לשפר את האפקט הטיפולי של רדיותרפיה על ידי ביצוע היפרתרמיה ותופעות הלוואי האפשריות (בעיקר תחושת חום, עייפות וכוויות בשומן התת עורי) הובהרו במלואן. לבסוף, טיפול בהיפרתרמיה יכול להתבצע רק לאחר שהמטופל הבין את היתרונות והחסרונות של הטיפול והסכים לטיפול על ידי חתימה על מסמכי הסכמה מדעת. מחקר רטרוספקטיבי זה נערך באישור המועצה לביקורת מוסדית של האוניברסיטה של הכותבים. כל הנתונים האישיים, כגון שמות וכתובות, היו אנונימיים כך שלא ניתן יהיה לזהות את הנבדקים ולאחסן אותם בכספת נעולה יחד עם התכתובת שלהם, תחת פיקוחו הקפדני של החוקר הראשי, בעת חקירת הנתונים מרשומות רפואיות אלקטרוניות וממכשירי הטיפול.
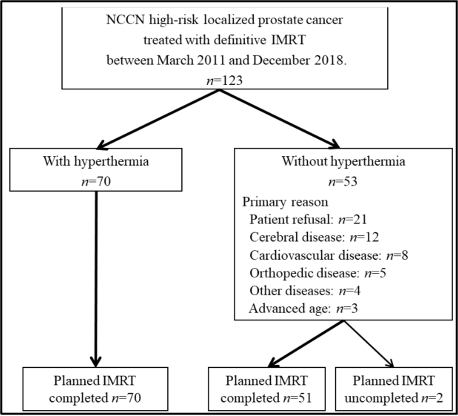
מטופלים עם קרצינומה של הערמונית בסיכון גבוה (n = 123), המוגדרים על פי ארגון חקר הסרטן העולמי (NCCN), טופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) בין מרץ 2011 לדצמבר 2018, בבית חולים מוסדי. במהלך אותה תקופה, על פי פרוטוקול הטיפול של מוסד החוקרים, שמטרתו היא לשפר את התוצאות הקליניות, תת-קבוצה מבין המטופלים (70/123; 57%) קיבלה היפרתרמיה אזורית (regional hyperthermia) בשילוב עם טיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) (איור 1); 53 המטופלים הנותרים טופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) דפיניטיבית (definitive) בלבד. האינדיקציות העיקריות נגד השימוש בהיפרתרמיה אזורית היו כדלקמן: סירוב המטופל (n = 21), מחלות מוחיות (n = 12), מחלות קרדיווסקולריות (n = 8), מחלה אורתופדית (n = 5), הימצאות של מחלות אחרות (n = 4), וגיל מתקדם (n = 3). שניים מתוך 123 המטופלים לא הצליחו להשלים את המינון המתוכנן של הטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) (76 Gy ב-38 מקטעים) ולא נכללו במחקר. לפיכך, נתונים מ-70 מטופלים שטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) בשילוב עם היפרתרמיה אזורית, ומ-51 מטופלים שטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) דפיניטיבית בלבד, נותחו רטרוספקטיבית (איור 1). מטופלים עם קרצינומה של הערמונית לאחר ניתוח (postoperative prostate carcinoma) לא נכללו במחקר זה.
להלן איור 1: תרשים זרימה של המטופלים.
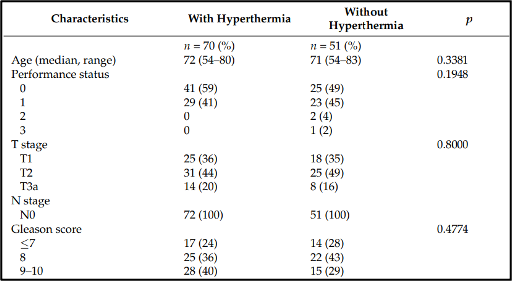
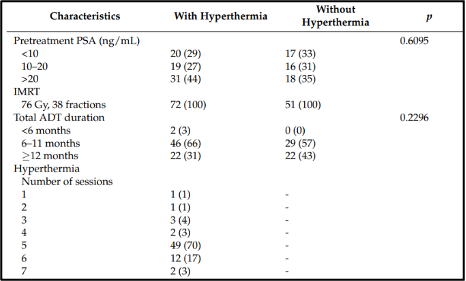
המאפיינים הבסיסיים והטיפולים של המטופלים מפורטים בטבלה 1. לכל המטופלים הייתה אדנוקרצינומה של הערמונית (prostate adenocarcinoma) שאומתה באופן פתולוגי והם עבור תחילה טיפול ניאו-אדג'ובנטי להפחתת אנדרוגן (ADT) למשך חציון של 9 חודשים (טווח בין-רבעוני של 7-11 חודשים). טיפול אדג'ובנטי להפחתת אנדרוגן (ADT) נמשך בכ-22 מטופלים לאחר השלמת הטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) למשך חציון של 24 חודשים (טווח בין- רבעוני של 22-33 חודשים). משך הזמן החציוני הכולל של טיפול ניאו-אדג'ובנטי יחד עם טיפול אדג'ובנטי להפחתת אנדרוגן (ADT) היה 10 חודשים (טווח בין- רבעוני של 8-18 חודשים).
להלן טבלה 1: מאפייני המטופלים.
קרינה מייננת בעלת עוצמה מאופננת (IMRT)
הטיפול הקרינתי ניתן לכל המטופלים עם כוונה דפיניטיבית (definitive intent) באמצעות מאיץ ליניארי (linear accelerator) של 10-MV (ONCOR Impression Plus, Siemens Medical Systems, Concord, CA). נפח היעד הקליני (clinical target volume) כלל את הערמונית כולה, מחלה חוץ-קפסולרית גולמית (gross extracapsular disease) ושלפוחיות זרע פרוקסימליות (proximal seminal vesicles). נפח היעד המתוכנן (planning target volume) הוגדר על ידי קווי המתאר של נפח היעד הקליני (CTV) עם שוליים של 7 מ"מ לכל הכיוונים למעט הפוסטריורי, שם השוליים היו רק 4 מ"מ. מדיניות מרשם המינון (dose prescription policy) של החוקרים התבססה על D95 של נפח יעד התכנון (PTV), כלומר אחוז המינון שנקבע מכסה 95% מהנפח. המינון הכולל המתוכנן (total planned dose) עבור כל המטופלים היה 76 Gy, עם פרקציה חלקית של 2.0 Gy פעם ביום, חמש פעמים בשבוע. המטופלים היו מקובעים באמצעות כריות Vac-Lok בתנוחת שכיבה וטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) "step-and-shoot". נעשה שימוש במערכת CT megavoltage cone beam כדי להתאים למיקום המטופל. מגבלות נפח המינון (Dose-volume constraints) עבור איברים בסיכון (at-risk organs) היו כדלקמן: פי הטבעת V50 Gy פחות מ-25%, V65 Gy פחות מ-17%; שלפוחית השתן V40 Gy פחות מ-50%, V65 Gy פחות מ-25%; ראש עצם הירך (femoral head) Dmax פחות מ-50 Gy, ומעי דק Dmax פחות מ-60 Gy.
היפרתרמיה
היפרתרמיה אזורית ניתנה באמצעות מכשיר קיבולי בתדרי רדיו (radiofrequency capacitive device) של 8 מגה-הרץ (Thermotron RF-8, Yamamoto Vinita Co., Osaka, Japan). המאפיינים הפיזיקאליים של מכשיר זה וההתפלגות התרמית (thermal distribution) שלו במודל פנטום (phantom model) ובגוף האדם תוארו בעבר. בקצרה, הן האלקטרודות העליונות והן התחתונות היו בקוטר של 30 ס"מ והונחו בצדדים המנוגדים של האגן כאשר המטופל נמצא בתנוחת פרון (prone position). מטרת הטיפול הייתה לפחות 30 דקות של חימום רציף לאחר שתפוקת תדרי הרדיו (radiofrequency output) הועלתה לסף הסבילות של המטופל. המטופלים הונחו בקפידה לדווח על הופעה של תחושות לא נעימות שמרמזות על נקודה חמה (hot spot). תפוקת תדרי הרדיו הוגדלה לרמה המקסימלית הנסבלת על ידי המטופל לאחר התאמה ראויה של הגדרות הטיפול. הנוזל בבולוסים הרגילים שנצמדו לאלקטרודת המתכת היה 5% תמיסת סליין (NaCl) או 5% אשלגן גופרתי (potassium sulfate), שניהם בעלי מוליכות דומה. כדי להפחית כל חימום עם העדפה (preferential heating) לרקמת השומן התת עורית, הוחלו בולוסים עם כיסוי על (overlay boluses) בנוסף לבולוסים הרגילים. הנוזל המחזורי (Circulating liquid) (0.5% NaCl או 0.5% אשלגן גופרתי; שניהם מדגימים מוליכות דומה) בתוך בולוסים של הכיסוי-על קוררו על ידי מערכת סירקולטורית (circulatory system) RF-8 במהלך החימום. קירור שטחי בוצע באמצעות נוזל במחזור (circulating liquid) שנקבע על טמפרטורה של 5 מעלות צלזיוס בבולוסים של הכיסוי-על. גזה ספוגה בתמיסת סליין (NaCl) של 10% הוכנסה לשסע הבין-גלוטאלי (intergluteal cleft) כדי לשפר את התפלגות הטמפרטורה בערמונית. חריגות התרחשו ב-4 מטופלים שקיבלו היפרתרמיה בשנת 2012; הם נכללו בניסוי קליני פרוספקטיבי קודם על אופטימיזציה של אזורי החימום העמוקים באמצעות מכשיר חימום זה ויריעות בידוד ניידות (mobile insulator sheets).
היפרתרמיה ניתנה פעם או פעמיים בשבוע, לאחר טיפול בהקרנות. החוקרים מדדו באופן ישיר את הטמפרטורה התוך-רקטלית (intra-rectal) בכל המטופלים ובמהלך כל מפגשי הטיפול בהיפרתרמיה באמצעות חיישן מיקרו-צמד תרמי בעל 4 נקודות (4-point micro thermocouple sensor) שהוכנס לתוך פי הטבעת בגובה הערמונית. המינון התרמי התואם לדקות המקבילות המצטברות (cumulative equivalent minutes) ב-43 מעלות צלזיוס עבור 90T (CEM43T90) הושג בהתבסס על הטמפרטורות התוך-רקטליות הללו במהלך כל מפגשי הטיפול בהיפרתרמיה. T90 הוא אינדקס טמפרטורה (index temperature) המעיד על השגה או עלייה ממעבר ל-90% מנקודות המדידה התוך-רקטליות; באופן דומה, T25 מצביע על השגה של טמפרטורת היעד או על כך שהיא חרגה מ-25% מנקודות המדידה התוך-רקטליות. ה-CEM43T90 נמצא בשימוש באופן נרחב ומוצלח בניסויים קליניים לצורך הערכת יעילות החימום ולצורך סיפוק נתונים על המינון התרמי האיזואפקטיבי (thermal isoeffect dose) המבוטא בדקות המקבילות המצטברות בטמפרטורת ייחוס של 43 מעלות צלזיוס בהתבסס על הקצה התחתון של התפלגות הטמפרטורה (T90). ה-CEM43T90 מחושב מנתוני הזמן-טמפרטורה (time-temperature) באופן הבא:
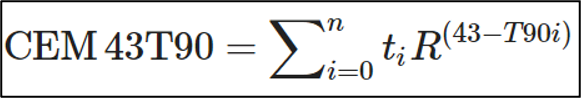
כאשר הטמפרטורה גבוהה מ-43 מעלות צלזיוס, R = 0.5. כאשר הטמפרטורה נמוכה מ- מעלות צלזיוס 43, R = 0.25. בפרוטוקול זה, ti הוא מרווח הזמן של ה-ith של הדגימה (ti = 1.0 min). טמפרטורות העולות על ה-T90 של נקודות המדידה התוך-רקטליות במהלך דקת ה-ith הוגדרו כ-T90i. לאחר מכן השתמשו החוקרים ב-CEM43T90 כדי להמיר כל T90i לזמן שווה ערך ב-43 מעלות צלזיוס, ואלה נוספו לאורך כל משך הטיפול של "n" דקות.
מעקב
משך המעקב חושב מתאריך ההתחלה של בטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT). המטופלים היו במעקב במרווחים של 1-3 חודשים במהלך השנה הראשונה וב-3-6 חודשים לאחר מכן. בכל ביקור מעקב נמדד ה-PSA, והוערכה תחלואה פוטנציאלית במערכת העיכול (gastrointestinal) ובמערכת המין ודרכי השתן (genitourinary). הישנות ביוכימית (Biochemical relapse) הוגדרה בהתאם להגדרת Phoenix. הימצאות של גרורות בעצמות אומתה על ידי מיפוי עצמות (bone scintigraphy), CT, או MRI, בעוד שגרורות של הרקמות הרכות (soft tissue metastasis) אומתו על ידי CT או MRI. הרעילות של הטיפול הוערכה על פי הקריטריונים הטרמינולוגיים המשותפים לתופעות לוואי (Common Terminology Criteria for Adverse Events), גרסה 4.0. רמת הרעילות הגבוהה ביותר עבור כל מטופל במהלך ואחרי הטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) שימשה לאנליזה של הרעילות. הרעילות סווגה כאקוטית (המתרחשת במהלך הטיפול או עד 3 חודשים לאחר הטיפול) או מאוחרת (המתרחשת לאחר יותר משלושה חודשים מהשלמת הטיפול).
ניתוחים סטטיסטיים
מבחן חי-בריבוע (Chi-squared test) או מבחן מאן-וויטני U (Mann–Whitney U test) שימשו להערכת הבדלים במאפיינים הקליניים בין מטופלים עם היפרתרמיה וללא היפרתרמיה. שיעורי ההישרדות ללא מחלות ביוכימיות (Biochemical disease-free survival) (Phoenix definition), ההישרדות ללא הישנות קלינית (clinical relapse-free survival) וההישרדות הכוללת (overall survival) חושבו מהתחלת הטיפוך בקרינה מייננת בעלת עוצמה מאופננת (IMRT) באמצעות שימוש בשיטת קפלן-מאייר (Kaplan–Meier method).כל ההבדלים המובהקים בין העקומות האקטואריות (actuarial curves) הוערכו באמצעות מבחן לוג-הדרגות (log-rank test). יחס הסיכון ורווח סמך של 95% חושבו באמצעות מבחן ואלד (Wald test). ניתוחים רב-משתניים באמצעות מודל הסיכונים הפרופורציונליים של קוקס (Cox proportional hazards) בוצעו גם כדי לזהות גורמים פרוגנוסטיים עבור ההישרדות. המבחן המדויק של פישר (Fisher’s exact probability test) שימש להשוואת רעילות בדרגה 2 ומעלה בין מטופלים עם היפרתרמיה וללא היפרתרמיה.
תוצאות
נתונים תרמיים
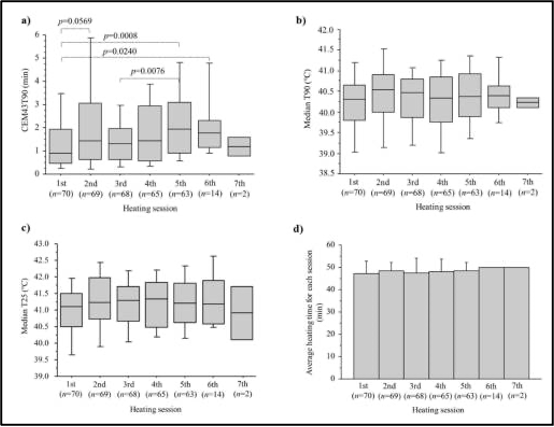
מספר פגישות הטיפול בחימום בכל מטופל נע בין 1-7 (חציון של 5) ומשך החימום החציוני לכל מפגש היה 50 דקות (טווח של 30-55 דקות). המינון התרמי של CEM43T90 נע בין 0.1 ל-32.1 דקות (חציון של 7.5 דקות). איור 2a מציג את ה-CEM43T90 עבור כל פגישת טיפול בחימום עם ערכי חציון עבור הפגישות הראשונות, השניות, השלישיות, הרביעיות, החמישיות, ה-6 וה-7, הם 0.9, 1.4, 1.3, 1.4, 1.9, 1.8 ו-1.2 דקות, בהתאמה. ה-CEM43T90 של הפגישה הראשונה נטה להיות נמוך יותר מזה של הפגישות טיפול המאוחרות יותר. ערכי ה-T90 החציוניים עבור מפגשי הטיפול 1–7 היו 40.3, 40.5, 40.5, 40.3, 40.4, 40.4 ו-40.2 מעלות צלזיוס, בהתאמה, (איור 2b) בעוד שאלו עבור ה-T25 היו 41.1, 41.2, 41.3, 41.3, 41.2, 41.2 ו-40.9 מעלות צלזיוס, בהתאמה (איור 2c). זמן החימום הממוצע עבור כל מפגש טיפול מוצג באיור 2d.
להלן איור 2: (a) המינון התרמי של CEM43T90, (b) חציון T90, (c) חציון T25, (d) זמן החימום עבור כל פגישת טיפול בהיפרתרמיה.
יעילות ופקטורים פרוגנוסטיים
זמן המעקב החציוני עמד על 64 חודשים (טווח בין-רבעוני של 49 עד 83 חודשים). טבלה 1 מספקת נתונים על ההבדלים במאפייני המטופלים בין שתי הקבוצות, ולא התגלו הבדלים מובהקים.
שיעורי ההישרדות ללא מחלה ביוכימית (bDFS) ל-3 שנים ול-5 שנים היו 92.2% ו-86.9%, בהתאמה, עבור כל 121 המטופלים, והישנות ביוכימית התרחשה ב-6 מטופלים בכל קבוצה. טבלה 2 מציגה את התוצאות של ניתוחים חד-משתנים של גורמים נבחרים המשפיעים על ההישרדות ללא מחלה ביוכימית (bDFS), והיפרתרמיה לא הייתה מנבא משמעותי להישרדות ללא מחלות ביוכימיות (bDFS). יתר על כן, שיעור ההישרדות ללא מחלה ביוכימית (bDFS) ל-5 שנים במטופלים עם היפרתרמיה וללא היפרתרמיה היה דומה ועמד על 89.8% ו-82.9%, בהתאמה (p = 0.2170, איור 3a). עם זאת, שיעור ההישרדות ללא מחלה ביוכימית (bDFS) למשך 5 שנים היה 96.4% בקרב 39 המטופלים עם CEM43T90 יותר מ-7 דקות, שהיה טוב יותר באופן מובהק מאשר ה-82.4% בשאר ה-82 המטופלים עם CEM43T90 ≤ ל-7 דקות או ללא טיפול בהיפרתרמיה (טבלה 2). טבלה 3 מפרטת את התוצאות של ניתוחים חד-משתניים של גורמים המשפיעים על הישרדות ללא מחלה ביוכימית (bDFS) ב-70 מטופלים שטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) בשילוב עם היפרתרמיה אזורית, ומינון תרמי של CEM43T90 גבוה יותר מ-7 דקות, היה גורם מנבא מובהק להישרדות ללא מחלה ביוכימית (bDFS). איור 3b מדגים ששיעור ההישרדות ללא מחלה ביוכימית (bDFS) ל-5 שנים של 96.4% ב-39 מטופלים עם CEM43T90 גדול מ-7 דקות היה טוב יותר באופן מובהק, מאשר 81.5% ב-31 מטופלים עם CEM43T90 ≤ ל-7 דקות (p = 0.0316) ו-82.9% ב-51 מטופלים שלא קיבלו היפרתרמיה (p = 0.0370).
להלן איור 3: שיעורי ההישרדות ללא מחלה ביוכימית (bDFS) וההישרדות ללא הישנות קלינית (RFS) (a) שיעורי ההישרדות ללא מחלה ביוכימית (bDFS) עם או ללא טיפול בהיפרתרמיה, (b) שיעורי ההישרדות ללא מחלה ביוכימית (bDFS) במטופלים שקיבלו מינון תרמי של CEM43T90 יותר מ-7 דקות, (c) השוואה בין שיעורי ההישרדות ללא הישנות קלינית (RFS) בין הקבוצות עם היפרתרמיה לבין ללא היפרתרמיה, (d) השוואה בין שיעורי ההישרדות ללא הישנות קלינית (RFS) בקרב מטופלים עם מינון תרמי של CEM43T90 יותר מ-7 דקות, למטופלים עם CEM43T90 ≤ ל-7 דקות, וללא טיפול בהיפרתרמיה.

להלן טבלה 2: ניתוח חד-משתני של גורמים מסוימים עבור ההישרדות ללא מחלה ביוכימית (bDFS), בעבור 121 מטופלים שטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) עם היפרתרמיה אזורית או ללא.

להלן טבלה 3: ניתוח חד-משתני של גורמים מסוימים עבור ההישרדות ללא מחלה ביוכימית (bDFS), בקרב 70 מטופלים שטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) בשילוב עם היפרתרמיה אזורית.

הישנות קלינית התרחשה במטופל אחד שטופל בהיפרתרמיה וב-4 מטופלים ללא טיפול בהיפרתרמיה, והאתרים של ההישנות הקלינית הראשונה היו בלוטות הלימפה (n = 2), בלוטת הלימפה והריאה (n = 2), והעצם ובלוטות הלימפה (n = 1). שיעורי ההישרדות ללא הישנות קלינית (RFS) ל-3 שנים ול-5 שנים היו 97.4% ו-93.9%, בהתאמה, עבור כל 121 המטופלים. טבלה 4 מציגה את התוצאות של ניתוחים חד-משתניים ורב-משתניים של גורמים הקשורים להישרדות ללא הישנות קלינית (RFS) והוספת היפרתרמיה הייתה גורם מנבא מובהק להישרדות ללא הישנות קלינית (RFS) הן בניתוחים חד-משתניים והן בניתוחים רב-משתניים. שיעור ההישרדות ללא הישנות קלינית (RFS) ל-5 שנים היה 98.0% עבור מטופלים שקיבלו היפרתרמיה, אך 88.6% בקרב מטופלים ללא היפרתרמיה (p = 0.0229, איור 3c). יתרה מכך, שיעור ההישרדות ללא הישנות קלינית (RFS) ל- 5 שנים היה 100% בקרב 39 המטופלים עם CEM43T90 יותר מ-7 דקות ו-95.0% ב-31 מטופלים עם CEM43T90 ≤ ל-7 דקות (איור 3d). שיעור ההישרדות הכוללת (OS) ל-5 שנים עמד על 100% בקרב המטופלים שקיבלו היפרתרמיה ו-95.9% בקרב המטופלים שלא קיבלו היפרתרמיה.
להלן טבלה 4: ניתוח חד-משתני ורב-משתני של גורמים מסוימים עבור הישרדות ללא הישנות קלינית (RFS), בעבור 121 מטופלים שטופלו בקרינה מייננת בעלת עוצמה מאופננת (IMRT) עם היפרתרמיה אזורית או ללא.

רעילות
דיון
מסקנות
למיטב ידיעת החוקרים, זהו הדווח הראשון שמעריך את היעילות, במונחים של תוצאות קליניות, של השילוב בין טיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) לבין היפרתרמיה אזורית במטופלים עם קרצינומה מקומית של הערמונית בסיכון גבוה. החוקרים מדגימים כי השימוש בטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT), בשילוב עם היפרתרמיה אזורית, היא שיטת טיפול מבטיחה שאינה קשורה לרעילות חמורה. התוצאות הללו של החוקרים תומכות בהערכה נוספת כגון ניסויים קליניים להערכת הטיפול בקרינה מייננת בעלת עוצמה מאופננת (IMRT) עם או ללא היפרתרמיה אזורית במטופלים עם קרצינומה מקומית של הערמונית בסיכון גבוה.



