
Thermochemoradiotherapy Improves Oxygenation in Locally Advanced Breast Cancer
Clinical Cancer Research 10.13 (2004): 4287-4293
Ellen L. Jones1, Leonard R. Prosnitz1, Mark W. Dewhirst1, P. Kelly Marcom2, Patricia H. Hardenbergh1, Lawrence B. Marks1, David M. Brizel1, and Zeljko Vujaskovic1
- Department of Radiation Oncology, Duke University Medical Centre, Durham, North Carolina
- Department Medical Oncology, Duke University Medical Centre, Durham, North Carolina
תקציר
מטרת המאמר – הישנות נותרה בעיה לא-פתורה עבור חולים שטופלו בעבר בהקרנות. מטרת החוקרים במאמר זה היא להעריך את תפקיד הקרינה-היפרתרמיה (RT-HT) בטיפול חוזר בהישנות שטחית.
חומרים שיטות – בין השנים 1998 ל-2007, 51 מטופלים שחלו בארבעה סוגים היסטולוגיים (הישנות שד (קבוצה A), הישנות מלנומה (קבוצה B), הישנות ראש וצוואר (קבוצה C) ואחר (קבוצה D)) של 76 נגעים שטחיים, נרשמו לבית החולים Mauriziano במכון המחקר לטיפול בסרטן Candiolo (IRCC) בטורינו. כל החולים עברו בעבר רדיותרפיה למעט 6 חולים מקבוצה B. מינון ממוצע כולל של הטיפול החוזר היה Gy 31.8 (20–60 Gy) בעוד הממוצע של טיפולי ההיפרתרמיה היה 5 (1 עד 8), טווח הטמפרטורה היה בין 38.5 מעלות צלזיוס (Tmin) ל-44 מעלות צלזיוס (T max).
תוצאות – רעילות עורית אקוטית הייתה 77.6% G2 22.4% ,G1, ללא G3. ארבעים וחמישה ימים לאחר מכן החוקרים הבחינו: עבור קבוצה A 65.9% תגובה מלאה (CR), 29.5% תגובה חלקית (PR), 4.5% אי-תגובה (NR); עבור קבוצה B 33.3% תגובה מלאה, 25% תגובה חלקית ו-41.7% ללא תגובה; עבור קבוצה C 40% תגובה מלאה (CR), 13.3% תגובה חלקית (PR), 46.7% אי-תגובה. עבור קבוצה D 60% תגובה מלאה ו-40% ללא תגובה. 18 חודשים לאחר מכן קבוצה A הדגימה 72.7% בשליטה מקומית (LC), 20.5% מחלה יציבה (SD) ו6.8% ללא שליטה (NC), קבוצה B 50% שליטה מקומית, 16.7% מחלה יציבה ו33.3% ללא שליטה, קבוצה C 33.3% שליטה מקומית, 40% מחלה יציבה ו26.7% ללא שליטה, קבוצה D הדגימה 40% שליטה מקומית ו60% ללא שליטה, תגובה מוקדמת, גודל הנגעים ≤3 ס"מ, מינוני T מקסימום ≥42 מעלות צלזיוס ו-הקרנות ≥40 Gy היו גורמי ניבוי לתוצאות.
מסקנות – החוקרים אוששו כי קרינה-היפרתרמיה יעילה בהקרנה חוזרת עם היענות גבוהה מאוד של מטופל.
מבוא
הטיפול בסרטן שד מקומי מתקדם (LABC) התפתח בעשור האחרון לגישה רב-תחומית, שעשויה לכלול כימותרפיה, טיפול הורמונלי, ניתוחים והקרנות. משטרים רבי-מודליות רבים ושונים נמצאים כיום בשימוש קליני. ההישרדות ללא מחלה למשך 5 שנים היא בדרך כלל בטווח של 30-50%, למרות טיפול אגרסיבי. כשל מקומי-אזורי חל ב-10-25% מכלל החולים, בעוד שגרורות מרוחקות מתפתחות ב-∼50%. חלק מהחולים כושלים הן באופן מקומי והן מרחוק. רוב משטרי השיטות המשולבות היו רציפים במהותם, לעתים קרובות תוך שימוש בכימותרפיה ניאו-אדג'ובנטית ואחריה גישות כירורגיות שונות והקרנות לאחר-ניתוח. מה שעושי להוביל לכך שתוכנית טיפול תימשך עד שנה עד להשלמתה.
זמן הטיפול הכולל אושש כמשפיע לרעה על תוצאות הטיפול בגידולים אחרים, כגון, צוואר הרחם וסרטן הראש והצוואר. המנגנון המשוער לכך הוא יישוב מחדש של הגידול, אשר עשוי להתרחש בגידולים המתרבים במהירות במהלך הטיפול. למרות שזמן הטיפול הכולל מעולם לא הוכח כמשפיע על התוצאה בסרטן שד מקומי מתקדם, משתנה זה עשוי להיות מדאיג בהתחשב בשיעורי הצמיחה האגרסיביים שנצפים לעתים קרובות עם גידול זה.
מחקר זה נועד להעריך את הישימות והיעילות של מתן טיפול הכולל שלוש מודליות בו-זמנית, כולל היפרתרמיה, כימותרפיה והקרנות ולאחר מכן ניתוח וכימותרפיה אדג'ובנטית נוספת. מטרת הטיפול המקביל היא: (א) לקצר את זמן הטיפול הכולל פי 2; (ב) לאפשר סינרגיה בין הקרנות, כימותרפיה והיפרתרמיה פי 2. מטרות המחקר היו להעריך את הייתכנות והסבילות של גישה שלוש-מודלית זו. נקודות סוף נוספות כללו את שיעורי התגובה הקלינית והפתולוגית, כמו גם מדידות ישירות של חמצון הגידול באתרו (in situ).
חומרים שיטות
מאפייני החולים והגידול
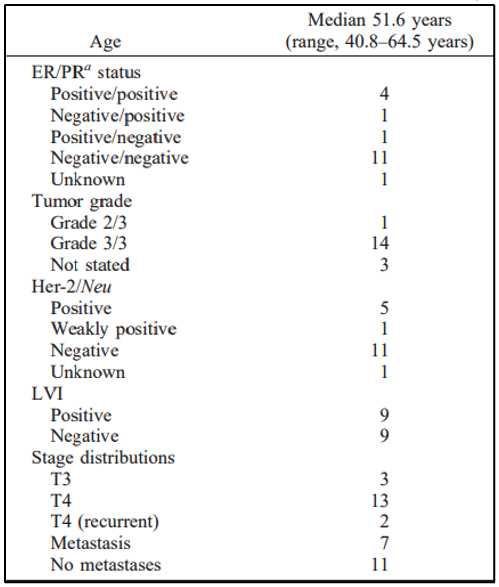
מנובמבר 1995 עד פברואר 1999, 18 חולים עם סרטן שד מקומי מתקדם או סרטן שד דלקתי הצטרפו לניסוי קליני פרוספקטיבי שאושר על ידי מועצת הביקורת המוסדית. התקבלה הסכמה מדעת בכתב. בדיקות לקביעת שלב הגידול כללו ביופסיית חתך, ממוגרפיה דו-צדדית, צילום רנטגן של החזה, סריקת עצם, טומוגרפיה ממוחשבת (CT) של החזה והבטן, וסריקת מוגה (MUGA-Multiple-gated Acquisition scan). כמו כן, הושלמה ספירת דם מלאה עם דיפרנציאלים וטסיות דם, כימיה של דם ובדיקות תפקודי כבד וכליות. חולים עם מקטע פליטה (ejection fraction) של <45%, WBC < 3,000 או ספירת נויטרופילים מוחלטת < 15,000, וטסיות < 100,000 לא נכללו. חולים עם גרורות מרוחקות בעת ההצגה או שקיבלו טיפול קודם נחשבו כשירים. ל-11 חולים לא היו גרורות, ול-7 חולים היו גרורות מרוחקות. הגיל החציוני היה 52. מאפייני מטופלים נוספים מפורטים בטבלה 1.
להלן טבלה 1: מאפייני החולים, הגידולים והטיפול.
שיטות טיפול
שדות משיקים (tangential fields) בטיפול ההקרנות תוכננו לכסות באופן מקיף את כל רקמת השד, כולל אזורי הגידול ושרשרת בלוטות הלימפה הסמוכה לעצם החזה (internal mammary nodal). על בסיס תכנון סריקות CT שנעשו בעריסה מקובעת מותאמת אישית במנח הטיפול, נקבע מיקום בלוטות הלימפה הסמוכה לעצם החזה (internal mammary nodal) ביחס לגבול העמוק של השדות המשיקים. אם השדות המשיקים שכללו את בלוטות הלימפה הסמוכה לעצם החזה (internal mammary nodal) היו בעלי נפח ריאה מקובל (המוגדר בדרך כלל כ-≤3.5 ס"מ של רקמת ריאה שנמדדה מהגבול הפוסטריורי של השדה המשיק ועד כלוב הצלעות הפנימי באיזוסנטר- isocenter), לרוב נעשה שימוש בגישה זו. לחלופין, שרשרת בלוטות הלימפה הסמוכה לעצם החזה (internal mammary nodal) נכללה בשדה מפנים נפרד המותאם לגבול המדיאלי של השדה המשיק באמצעות תערובת של פוטונים ואלקטרונים. קשריות הלימפה מעל עצם הבריח (supraclavicular nodes) טופלו באמצעות שדה נפרד עם התאמה לא-מסועפת לשדה המשיק. נעשה שימוש בגישה אלכסונית קדמית (anterior oblique) עם שדה בזווית של 15° לרוב, לצד הנגדי (contralateral) כדי לכלול את קשריות הלימפה הסופרה-קלויקולריות המדיאליות, אך להימנע מיציאה לחוט השדרה. הקרינה ניתנה ב 200 cGyליום לסך של 5000 cGy לשד, לקשריות הלימפה הסופרה-קלויקולריות ולבלוטות הלימפה הסמוכה לעצם החזה (internal mammary nodal). ניתן בוסט למינון הכולל של 60-65 Gy למי שלא עבר ניתוח. bolus wedges שוות ערך לרקמות שימשו כסממן קליני כדי להבטיח את המינונים הנכונים לגידולים שטחיים ולמזער את הטרוגניות היעד.
כימותרפיה
Taxol (175 mg/m2) ניתן כל 3 שבועות במשך שלושה מחזורים. הטיפול הקרינתי החל יומיים לאחר מנת הTaxol הראשונה. המטופלים קיבלו פרה מדיקציה דקסמתזון (dexamethasone), דיפנהידרמין (diphenhydramine) וסימטידין (cimetidine), ושינויי מינון על פי קריטריוני הרעילות הנפוצים של המכון הלאומי לסרטן (v2.0-National Cancer Institute Common Toxicity Criteria) התבססו על ספירות הדם ורעילות ביניים לא המטולוגית של המחזור הקודם. מינון הכימותרפיה לא הופחת אלא אם כן נדרש אשפוז בגין חום נויטרופני, צורך בעירויי טסיות לספירות <20,000, או אם היה דימום משמעותי.
היפרתרמיה
טיפולי היפרתרמיה נתנו פעמיים בשבוע, תוך 30 דקות לאחר ההקרנות. הטיפול הראשון בהיפרתרמיה ניתן לאחר הפרקציה הראשונה של ההקרנות. בסך הכל נקבע מתן של 10 טיפולי היפרתרמיה למסת הגידול עם גלי-מיקרו (433 או 915 MHz) תוך שימוש בטכניקות המקובלות לבחירת תרמומטריה ומיקום. חולים קיבלו באופן שגרתי פרה מדיקציה של לוראזפאם או תרופה נרקוטית. לידוקאין HCL (1% solution buffered with 0.1 mEq sodium barcarbonate/ml lidocaine) שימש כהרדמה מקומית להצבת צנתר התרמומטריה. גלי-מיקרו שהושמו חיצונית שימשו לכל הנגעים בעובי <3 ס"מ. גלאי תרמומטריה של סיבים אופטיים הוכנסו לתוך קטטרים סטריליים (blind-ended) שהוכנסו לגידול בהתאם להנחיות קבוצת האונקולוגיה לטיפול קרינתי (Radiation Therapy Oncology Group). מדידות טמפרטורה נעשו לאורך הקטטר במרווחים של 5 מ"מ כל 10 שניות. מיקומי הצנתרים אומתו במהלך ההצבה על ידי סריקת CT. בדיקות הונחו גם על העור וליד קווי צלקת כדי לנתר רקמות תקינות על פני השטח. מטרת הטיפול הייתה להגיע ל-41-41.5 מעלות צלזיוס ב>90% מהנקודות שנמדדו למשך 60 דקות. אם זה הושג במהלך 10 פרקציות של היפרתרמיה, הדקות המקבילות המצטברות של 43 מעלות צלזיוס T90 יהיו ≥ 10 (equivalent minutes 43°C T90). מושג מינון תרמי זה תואר קודם לכן. הטמפרטורות המרביות המותרות ברקמה הנורמלית הסמוכה ובגידול היו 43 מעלות צלזיוס ו-48 מעלות צלזיוס, בהתאמה. הכוח המופעל הותאם כדי להגיע להתפלגות הטמפרטורה הרצויה מבלי לחרוג מטמפרטורות הרקמה הרגילות או הסובלנות של המטופל.
מדידות חמצון
מדידות חמצון (pO2) בוצעו במהלך ההקרנות, לפני הטיפול הראשון בהיפרתרמיה ו24 שעות לאחר הטיפול הראשון בהיפרתרמיה באמצעות מכשיר פולרוגרפי (polarographic) (Eppendorf Netheler Hinz, GmbH, המבורג, גרמניה). טכניקה זו תוארה בעבר. אלקטרודות פולארוגרפיות כוילו לפני ואחרי המדידות בNaCl עם בופר פוספטים עם אוויר החדר ו-100% חנקן בטמפרטורת החדר. מיקום הגידול, הערכת גודל הגידול והעומק מפני שטח העור ועד לקצה ההיקפי של הגידול נקבעו באמצעות סריקת CT. לאחר קביעת וסימון אתר ההחדרה, העור שמעל האזור נוקה עם betadine והורדם עם 2% לידוקאין. בהנחיית CT הוכנסה מחט 16 gauge והונחה בקצה הגידול. כלל מסלול המדידה הותאם בהתאם לגודל הגידול, כך שהמדידות בוצעו רק ברקמת הגידול. הגלאי (Probe) התקדם באופן אוטומטי קדימה בצעדים של 0.7 מ"מ ולאחר מכן צעד אחורה של 0.3 מ"מ עם מרווחים נטו של 0.4 מ"מ. התקבלו מספר מסלולי בדיקה עם לפחות 100 נקודות מדידה שונות של pO2 שנאספו לכל גידול בכל סשן מדידה.
סטטיסטיקה
בהתחשב במספר הקטן של המטופלים ובאופי שלב 1 של המחקר, שיעורים גולמיים משמשים לתיאור התוצאות.
תוצאות
תגובה קלינית ופתולוגית ותוצאות המטופלים
המטופלים נצפו 3-4 שבועות לאחר סיום הטיפול בשלוש-מודליות כדי לדרג את התגובה הקלינית ולגבש סופית את התוכניות לכריתת שד (mastectomy), בהתאם לצורך. מתוך 18 המטופלים שנרשמו, ל-6 הייתה תגובה קלינית מלאה (CR), שהוגדרה כהיעדר מוחלט של גידול בבדיקה גופנית. לתשעה חולים הייתה תגובה קלינית חלקית, שהוגדרה כהפחתה של >50% בנפח הגידול הראשוני. שלושה חולים היו עם מחלה יציבה ללא תגובה קלינית. 13 מטופלות עברו כריתת שד (mastectomy). מבין 6 המטופלות עם תגובה קלינית מלאה, ל-3 הייתה תגובה פתולוגית מלאה בשתי דגימות השד, כמו גם ללא עדות למעורבות בלוטות בבית השחי (axillary node). שיעור תגובה קלינית פתולוגית מלאה מוערך, אם כן, ב -23% (95% רווח בר-סמך, 5-54%). 14 מתוך 18 המטופלים שנרשמו בחיים עם מעקב חציוני של 11 חודשים מאז סיום הטיפול (טווח, 2.4-40.8). לחולה אחד היה כישלון מקומי. שתי מטופלות נכשלו בשד הנגדי או בבית השחי (axilla) הקונטרלטרלי, לאחר תגובות פתולוגיות קליניות מלאות וחלקיות.
רעילות
השילוב של קרינה, Taxol והיפרתרמיה היה נסבל במידה סבירה במסגרת האקוטית. 16 מתוך 18 חולים פיתחו קילוף לח של העור (moist desquamation) בהיקף משתנה, דבר שאינו בלתי צפוי בהתחשב בגודל הגידול, שדות קרינה גדולים ושימוש בבולוס בעת הצורך. אחד מהחולים הללו לא הצליח להשלים את 5000 cGy שנקבעו עקב תגובת עור אקוטית. חולה אחד לא הצליח להשלים את 10 טיפולי ההיפרתרמיה הצפויים בגלל כוויה מדרגה שלישית. מטופל שני פיתח גם אזור קטן (<1 ס"מ) של כוויה מדרגה שלישית אך השלים את התוכנית. שני חולים נוספים פיתחו כוויות מדרגה שנייה, וחולה אחד סבל מנמק בשומן התת עורי (s.c. fat necrosis). נמק שומני הוא פגיעה תרמית ברקמות התת עוריות (subcutaneous) בהעדר כוויה עורית. שני חולים פיתחו המטומות הקשורות להחדרה של צנתרי תרמומטריה להיפרתרמיה. אלה עברו לבדם והסתדרו באמצעים שמרניים.
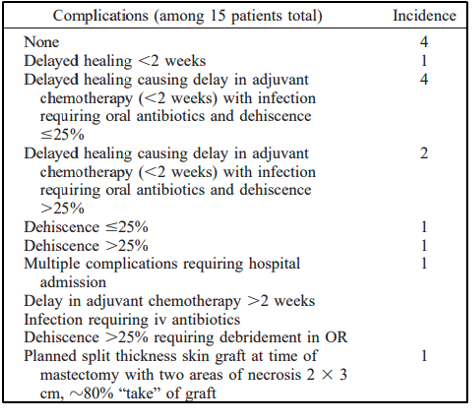
סיבוכים לאחר כריתת שד התרחשו בקרב 9 מתוך 13 המטופלות שעברו כריתת שד (mastectomy). הפרטים מפורטים בטבלה 2. ניתוחים פלסטיים לשחזור לא נדרשו באף אחד מהמקרים. כולם נרפאו באמצעים שמרניים.
להלן טבלה 2: תלונות המטופלים שעברו XRT /Taxol/HT mastectomy
תוצאות תרמומטריה
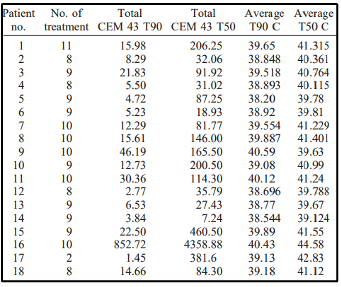
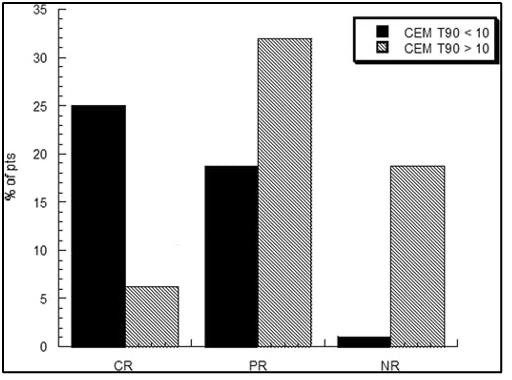
המספר הממוצע של טיפולים בהיפרתרמיה היה 8.7 (טווח,2-11). פרמטרים תרמיים עבור כל מטופל מוצגים בטבלה 3. היעד התרמי של 10 דקות שוות ערך מצטברות של 43° T90 (10 cumulative equivalent minutes 43° T90) הושג ב10 מתוך 18 מטופלים. לא נמצא קשר ברור בין הגדלת המינון התרמי לבין שיפור תגובת הגידול. למעשה, המגמה ההפוכה התרחשה עבור כל ארבעת הפרמטרים התרמיים שנבדקו. הקשר השלילי בין מינון תרמי לתגובת הטיפול היה משמעותי עבור ערכי T90°C (P=0.009; איור1). יתר על כן, שיעורי התגובה היו נמוכים יותר באלה שהשיגו את המטרה התרמית (cumulative equivalent minutes 43° T90>10) מאשר באלה שלא השיגו (איור2).
להלן טבלה 3: סיכום נתונים תרמיים
להלן איור 1: הקורלציה בין פרמטרים תרמיים (CEM 43°T90, CEM 43° T50, T90 C&T50 C) ותגובה ראשונית לטיפול
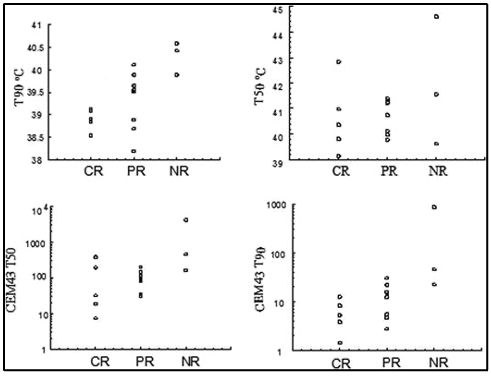
להלן איור 2: הקורלציה בין תגובה לטיפול ובין השגת היעד התרמי (CEM T90 10)
חמצון הגידול (Tumor Oxygenation)
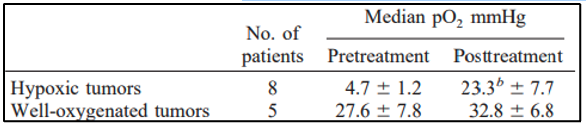
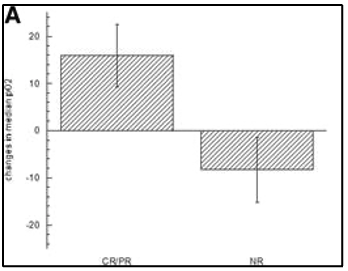
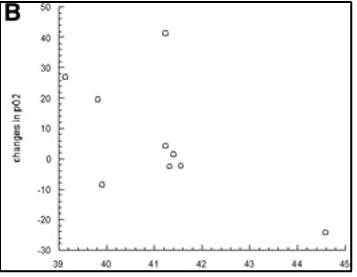
לפני הטיפול, חמצון הגידול נמדד ב-13 מתוך 18 חולים, עם חציון ממוצע ± SE pO2 של 13.5 ± 4.3 מ"מ כספית. היפוקסיה של הגידול (pO2<10 mmHg חציוני) הייתה קיימת ב-8 מתוך 13 חולים (חציון ממוצע ± SE pO 2 = 4.7 ± 1.2 מ"מ כספית). לחמשת החולים האחרים היו גידולים מחומצנים היטב (ממוצע חציוני ± SE pO2 = 27.6 ± 7.8 mmHg). לאחר היפרתרמיה pO2 נמדד בכל החולים שעברו מדידות בסיסיות. לא נרשמה עלייה מובהקת סטטיסטית ב-pO2 24 שעות לאחר הטיפול הראשון בהיפרתרמיה (ממוצע חציון ± SE pO2 של 20.4 ± 6.4 מ"מ כספית). לחולים עם גידולים היפוקסיים לפני הטיפול היה שיפור משמעותי (P = 0.0002) בpO2 של הגידול לאחר הטיפול הראשון בהיפרתרמיה (ממוצע חציוני ± SE pO2 עלה ל23.3 ± 7.7 מ"מ כספית). תוצאות חמצון הגידול מסוכמות בטבלה 4. לחולים עם גידולים מחומצנים היטב לפני הטיפול, כמו גם לאלה עם חמצון מחודש משמעותי, הייתה תגובה קלינית חיובית לטיפול (תגובה מלאה או תגובה חלקית) עם עלייה ממוצעת של ± SE ב-pO2 של 15.8 ± 6.6 מ"מ כספית. עם זאת, ירידה משמעותית (P = 0.002) בחציון ממוצע ± SE pO2 של 8.3 ± 6.9 נצפתה בחולים שלא הגיבו לטיפול (איור 3,A). יתר על כן, מתאם בין שינויים בחמצון מחודש של הגידול לבין פרמטר תרמי T50°C הראה שטמפרטורה גבוהה יותר קשורה לאובדן אפקט החמצון מחודש (איור 3 B).
להלן טבלה 4: סיום של תוצאות המדידה של pO2
להלן איור 3 (A): שינויים בחציון הממוצע של חמצון (pO2) לאחר טיפול בהיפרתרמיה במגיבים [תגובה מלאה (CR) ותגובה חלקית (PR) ולא מגיבים (NR)]. מטופלים שהגיבו לטיפול הם אלו שחוו עלייה ב pO2 של הגידול לאחר הטיפול
להלן איור 3 (B): קורלציה בין השינויים בחמצון מחודש לבין הפרמטר התרמי T50 C; bars, ±SD
דיון – שיקולים קליניים
חולים עם סרטן שד מקומי מתקדם נמצאים בסיכון משמעותי למחלות מקומיות-אזוריות וסיסטמיות; לפיכך, טיפול רב-מודלי שימש במגוון של אסטרטגיות. המכון הלאומי לסרטן השתמש בכימותרפיה או כימותרפיה עם סנכרון הורמונלי לתגובה מקסימלית בניסוי פרוספקטיבי ניאו-אדג'ובנטי של 107 חולים. עבור אותם חולים שהשיגו תגובה קלינית מלאה, בוצעו ביופסיות מרובות, והתגובה הפתולוגית שימשה לקביעת הטיפול המקומי. תגובות קליניות אובייקטיביות (תגובה קלינית חלקית ומלאה) התקבלו ב-92% מהחולים. עשרים ותשעה אחוזים מכלל קבוצת החולים היו עם תגובה פתולוגית מלאה דרך ביופסיה מכוונת, לא כריתת גוש או כריתת שד.
ניסוי פרוספקטיבי מאוחר יותר עם 89 מטופלים באוניברסיטת מישיגן השתמש בתשעה מחזורים של טיפול הורמונלי כימותרפי ניאו-אדג'ובנטי עם מגיבים פתולוגיים מלאים שטופלו בקרינה בלבד. שיעור התגובה הקלינית הכולל היה 97% (קליני, חלקי ו-CRs), ול-28% מהמטופלים הייתה תגובה פתולוגית מלאה כפי שנבחן על ידי ביופסיות מכוונות.
המחקר הגדול ביותר של כימותרפיה ניאו-אדג'ובנטית לחולי סרטן השד נערך על ידי National Surgical Adjuvant Breast and Bowel Project. החולים כללו קבוצה בשלב מוקדם יותר עם סרטן שד בר מישוש, הניתן לניתוח(T1,2,3N 0,1ו-M0). במחקר ההוא, 1523 נשים חולקו באקראי לניתוח ואחריו כימותרפיה אדג'ובנטית דוקסורוביצין/ציקלופוספאמיד (doxorubicin/ cyclophosphamide) לעומת כימותרפיה אדג'ובנטית דוקסורוביצין/ציקלופוספאמיד (doxorubicin/ cyclophosphamide) ולאחר מכן ניתוח. תגובה פתולוגית מלאה כוללת התרחשה רק ב-9% מהחולים שטופלו בכימותרפיה אדג'ובנטית דוקסורוביצין/ציקלופוספאמיד. עם זאת, 4% נוספים מהחולים נמצאו כבעלי גידול שיורי באתרו (in situ) בלבד, מה שהביא ל-13% תגובה פתולוגית מלאה כוללת לגידול פולשני. שבעה אחוזים מהחולים עם בלוטות חיוביות מבחינה קלינית לפני טיפול ניאו-אדג'ובנטי נמצאו כבעלי תגובה פתולוגית מלאה בזמן הסרת קשריות הלימפה מבית השחי על ידי ניתוח (axillary dissection).
תוך שימוש בגישה שונה, 36 מטופלים עם סרטן שד מקומי מתקדם (שלבים IIB, III ו-IV, אדנופתיה סופרקלביקולרית בלבד) שהוגדרו בתחילה בלתי ניתנים לניתוח עם סגירת פצע ראשונית טופלו בקורס של פלואורואורציל (5-fluorouracil) לפני הניתוח והקרנות בו זמנית. שיעור התגובה הקלינית האובייקטיבית כימורדיותרפיה ניאו-אדג'ובנטית זו היה 73%, וכולם הצליחו לעבור כריתת שד רדיקלית מותאמת (modified radical mastectomy) עם סגירת הפצע הראשוני. ל-17% מהחולים הייתה תגובה פתולוגית מלאה, ול-20% הייתה מחלה מיקרוסקופית מינימלית. בסדרה הנוכחית, היה לחוקרים שיעור תגובה פתולוגית מלאה של 3 מטופלות מתוך 13 מטופלות שעברו כריתת שד (23%), אך הסיבוכים לאחר הניתוח היו שכיחים יחסית (טבלה 2).
תגובת מינון תרמי
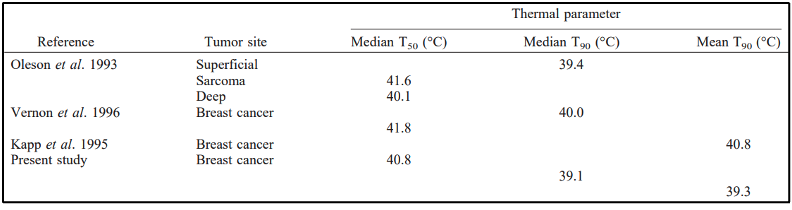
השפעת ההיפרתרמיה על תגובת הגידול בטיפול רב-מודלי היא סוגיה מורכבת המערבת מנגנונים ביולוגיים ופיזיולוגיים. אינטראקציה ורצף של שיטות טיפול שונות בהחלט מציגים רמה נוספת של מורכבות. ידוע כי היפרתרמיה עלולה לגרום ו/או להגביר נזק ישיר לרקמות ולהרוג תאים, לעכב תיקון נזקי DNA ולגרום לחמצון מחודש של הגידול. השפעות אלה של היפרתרמיה תלויות בטמפרטורה. עם זאת, איזו השפעה היא החשובה ביותר כאשר ניתנת בשילוב עם כימורדיותרפיה לא בוססה ועשויה להשתנות על פני טווח של טמפרטורה ומינון תרמי. בהשוואה לסדרות אחרות, מינונים תרמיים מהמחקר הנוכחי הם בדרך כלל נמוכים יותר מאשר מינונים תרמיים שדווחו בניסויים הקליניים (טבלה 5). מינונים תרמיים גבוהים יותר עשויים להיות מעורבים יותר בעיכוב של תיקון DNA וציטוטוקסיות ישירה, בעוד שמינונים נמוכים יותר עשויים להשפיע בעיקר על חמצון מחודש.
להלן טבלה 5: סיכום של פרמטריים תרמים ממחקרים אחרים בהשוואה לתוצאות הנוכחיות.
מחקר זה הראה קשר פרדוקסלי בין מינון תרמי לתגובת הטיפול. נראה כי חולים המקבלים מינונים תרמיים נמוכים יותר נוטים להגיב טוב יותר לטיפול מאשר חולים עם מינונים גבוהים יותר (איור 1 ו2). על בסיס נתוני החוקרים המדגימים כי חמצון מחודש של גידולים תלויי טמפרטורה (איור 3,B) ויחסי מינון-תגובה תרמיים (איור 1), החוקרים מאמינים שהקשר התרמי בין מינון לתגובה שנצפה בניסויים עם מינונים תרמיים גבוהים יותר קשור להשפעות ההיפרתרמיה על ציטוטוקסיות ישירה של הגידול ותיקון נזקי DNA, בעוד שאפקט החמצון המחודש הוא אופן האינטראקציה השולט בטווח המינונים של קבוצה זו.
במערך נתונים מוגבל זה, חשוב להכיר בכך שניתן רק ליצור השערות למחקר נוסף, משום שהיכולת לזהות הבדלים אמיתיים בין הקבוצות מוגבל. בהתחשב בזהירות זו, החוקרים משערים כי הקשר הפרדוקסלי בין מינון תרמי לבין התגובה לטיפול, נובע מחמצון מחודש של הגידול התלוי בטמפרטורה. החוקרים מציעים כי חמצון מחודש וכתוצאה מכך שיפור התגובה הקלינית עלולים לעקוב אחר עקומת פעמון ביחס למינון תרמי. במילים אחרות, השיפור המרבי בחמצון הגידול ובתגובת הטיפול יכול להיות מושג רק בטווח אופטימלי של מינונים תרמיים.
התגובות טובות יותר כאשר הגידולים מחומצנים היטב, או לפני הטיפול או אם הpO2 עולה 24 שעות לאחר הטיפול הראשון בחום. היתרונות של היפרתרמיה במסגרת הקלינית (מלבד ההשפעות הציטוטוקסיות והרדיוסנסיטיזציה שלה) עשויים לנבוע משיפורים בחמצון, כפי שהודגם קודם לכן בסדרה של בני אדם חולי סרקומה. תוצאות ממספר מחקרים בגידולי מכרסמים ושתלים של גידולים אנושיים תומכות ברעיון ששיפור כללי בחמצון הגידול יכול לנבוע ממינונים תרמיים נמוכים יותר, בעוד שבמינונים תרמיים גבוהים יותר חמצון הגידול פוחת. תוצאות אלה נבחנו על ידי Song ואח’. היפרתרמיה משפרת את חמצון הגידול הן בסרקומות של רקמות רכות אצל כלבים והן בסרקומות של רקמות רכות אצל בני-אדם. המחקר הנוכחי מדגים כי ניתן להשיג שיפור בחמצון הגידול לאחר טיפול בהיפרתרמיה גם בסרטן שד מקומי מתקדם. עם זאת, התוצאות הנוכחיות מצביעות גם כן על כך שחמצון מחודש של הגידול פוחת עם מינונים תרמיים גבוהים יותר (איור 3B), והכישלון בחמצון מחודש קשור לתוצאות טיפול רעות יותר. תוצאה זו מצביעה בבירור על כך שיעילות ההיפרתרמיה במסגרת זו נובעת מיכולתה לחמצן מחדש גידולים.
מכיוון שחמצון מחודש מתרחש במינונים תרמיים נמוכים יותר, יש לבצע הערכה מחודשת של המטרות התרמיות להיפרתרמיה. עניין זה יכול להיות בעל חשיבות גם אם היפרתרמיה משולבת עם כימותרפיה בשל פעילות תלוית-חמצן של חלק מהחומרים הכימותרפיים. במחקרים בבעלי חיים הודגם כי שיפור בחמצון הגידול מגביר את הרג תאי הגידול באמצעות ציקלופוספאמיד (cyclophosphamide), 1,3 bis(2-chloroethyl)-1-nitrosourea, אדריאמיצין (Adriamycin) וTaxol. יחס המינון התרמי האיזו-אפקטיבי עבור תרמו-כימורדיותרפיה עשוי להיות שונה מזה של תרמו-רדיותרפיה.
מהלך הזמן של שיפורים הנגרמים על ידי היפרתרמיה בחמצון הגידול חשוב לטיפול המשולב בכימותרפיה/הקרנות/היפרתרמיה. Horsman וOvergaard דיווחו כי השיפורים בחמצון הגידול כתוצאה מהיפרתרמיה קלה בקרצינומה של השד בעכבר C3H היו זמניות. התוצאות שלהם הציעו כי כל עלייה בציטוטוקסיות הקרינה אשר נובעת מהחמצון המשופר התרחשה רק אם הקרינה ניתנה בו זמנית או זמן קצר לאחר היפרתרמיה. לעומת זאת, תוצאות ממחקרי סרקומה של כלבים ובני אדם מצביעות על כך ששיפורים בחמצון נמשכים עד 24 שעות לאחר היפרתרמיה. ממצאים דומים דווחו על ידי Iwata ואח’. וShakil ואח'. בשני המחקרים השיפור בחמצון הגידול נמשך לפרקי זמן של עד 24 שעות לאחר שעה אחת של טיפול בהיפרתרמיה בטמפרטורה של 41.5 מעלות צלזיוס. כמו כן, שיפור מתמיד בחמצון נצפה הן בסרקומה אנושית והן בחולות סרטן השד 24 שעות לאחר היפרתרמיה. המחקר הנוכחי מאשר כי השפעות החמצון המחודש על גידולים אנושיים הנגרמות על ידי היפרתרמיה יכולות להימשך לפחות 24 שעות.
המנגנון של חמצון המושרה על ידי היפרתרמיה יוחס בתחילה לשינויים הנגרמים על ידי היפרתרמיה בזרימת הדם של הגידול. על סמך מודלים של הובלת חמצן מוצע כי ייתכן שתידרש עלייה של לפחות פי 5-10 בהזרמת הגידול כדי להשיג את רמת השיפור בחמצון הגידול שנצפתה במחקרי סרקומה בקרב כלבים. לכן, סביר להניח כי חמצון מוגבר של הגידול מושפע גם כן מהשפעות החום על צריכת החמצן ורמות ה-ATP. צריכת חמצן וסינתזת ATP במיטוכונדריה הם תהליכים מוצמדים. בגלל הרגישות התרמית המובהקת של תהליך שרשרת הנשימה התאית במיטוכונדריה, צריכת החמצן לאחר היפרתרמיה יורדת. שיפור בחמצון הגידול הוא ככל הנראה תוצאה של שני התהליכים, הירידה בצריכת החמצן ועלייה בזרימת הדם של הגידול.
ייתכן גם כי כימותרפיה תורמת לחמצון מחודש לטווח ארוך. Milas ואח'. הציגו כי חמצון מחודש מתרחש ב MCA-4 murine קרצינומה של השד (mammary carcinoma) 24 שעות לאחר טיפול Taxol. ערכי pO2 חציוניים עלו מ-6.2 מ"מ כספית בגידולים לא מטופלים ל-10.0 מ"מ כספית בגידולים שטופלו. החוקרים הציעו כי שיפור תגובת הגידול להקרנות על ידי Taxol מתווך על ידי חמצון מחודש של תאי גידול היפוקסיים. עם זאת, במחקר הנוכחי כל תרומה של Taxol ו/או הקרנות על חמצון מחודש של הגידול נלקחה בחשבון במדידות pO2 לפני הטיפול בהיפרתרמיה. לכן, שינויים בערכי pO2 במחקר זה הושפעו בעיקר מהיפרתרמיה.
לסיכום, ממצאים קודמים יותר של חוקרים אלה, התייחסו לקשר בין חמצון הגידול למינון תרמי, ותוצאות מחקר זה מצביעים על כך שהשינויים בחמצון הגידול תלויים בטמפרטורה וכי קשר זה עשוי להשפיע על תוצאות הטיפול. כמו כן, סביר להניח כי במינונים תרמיים נמוכים יותר (אשר ניתנים להשגה בקלות בקליניקה) חמצון מחודש של הגידול רלוונטי יותר לתגובת הגידול מאשר האפקט הציטוטוקסי עצמו. זהו יכול להיות חשוב במיוחד עבור פרוטוקולים תרמו-כימורדיותרפיה (thermochemoradiotherapy) הכוללים חומרים כימותרפיים אשר פעילותם ידועה בהיותה תלוית חמצן. עם זאת, בהתחשב במגבלות בשל המספר הקטן של חולים במחקר זה, חשוב לערוך מחקרים קליניים נוספים שבהם נמדדים פרמטרים של מינון תרמי וחמצון כדי לקבוע בצורה מדויקת יותר את הקשר התרמי בין מינון-חמצון-תגובה. לכן, מחקר ראשוני זה עשוי לסייע בביסוס הטווח של המינון התרמי האופטימלי לשילוב היפרתרמיה עם הקרנות וכימותרפיה. יתר על כן, משטר זה הביא לשיעור גבוה של תגובה פתולוגית מלאה (23%), דומה באופן חיובי לסדרות אחרות של חולות שד מקומי מתקדם.
זהו המחקר הראשון בבני אדם החולים בסרטן השד, שמראה כי שינויים בחמצון הגידול תלויים בטמפרטורה וכי השיפור בחמצון עשוי להיות קשור לתוצאות הטיפול ולתגובה הפתולוגית. במחקרים עתידיים, החוקרים מקווים לעשות קורלציה בין חמצון הגידול עם מדידות לא פולשניות אחרות של פיזיולוגיה של הגידול באמצעות תהודה מגנטית ספקטרוסקופית (magnetic resonance spectroscopy). באופן אידיאלי, זה יהיה יחד עם תרמומטריה לא פולשנית מבוססת תהודה מגנטית כדי לקבוע את הייצוג התלת-ממדי המלא של המינון התרמי, אשר עשוי להיות מתואם במדויק עם השינויים בפיזיולוגיה של הגידול והתגובה הקלינית שלאחר מכן.



