Prospective phase II trial of regional hyperthermia and whole Radiofrequency deep hyperthermia combined with chemotherapy in the treatment of advanced non-small cell lung cancer irradiation for numerous chemorefractory liver metastases from colorectal cancer
Chinese medical journal, 2019 April, vol.132:8,922-927
Wen-Hui Yang1,2, Jun Xie1, Zhi-Yong Lai2, Mu-Dan Yang3, Ge-Hong Zhang4, Yuan Li5, Jian-Bing Mu6, and Jun Xu2
- Department of Biochemistry and Molecular Biology, Shanxi Medical University, Taiyuan, Shanxi 030001, China
- Shanxi Academy of Medical Sciences, Shanxi Dayi Hospital, Taiyuan, Shanxi 030032, China
- Shanxi Province Cancer Hospital, Affiliated Cancer Hospital of Shanxi Medical University, Taiyuan, Shanxi 030013, China
- The First Hospital of Shanxi Medical University, Taiyuan, Shanxi 030001, China
- Department of Thoracic Surgery, National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
- Laboratory of Malaria and Vector Research, National Institute of Allergy and Infectious Diseases, National Institutes of Health, Rockville, MD 20852, USA.
תקציר
רקע – בעידן הרפואה המדויקת, כימותרפיה עדיין נחשבת לאבן היסוד של הטיפול בחולי סרטן ריאה ללא מוטציות גנטיות. כדאי לחקור כיצד להפחית את הרעילות ולהגביר את היעילות של הכימותרפיה. מחקר זה נועד לחקור את ההשפעות המרפאות ואת הבטיחות של היפרתרמיה בשילוב עם כימותרפיה (HCT) עבור חולים עם סרטן מתקדם של הריאות מסוג תאים לא קטנים (non-small cell lung cancer), במיוחד אלה עם תפליט פלאורלי על רקע ממאירות (malignant pleural effusion)
שיטות– החוקרים העריכו באופן רטרוספקטיבית את הרשומות הרפואיות של 93 מטופלים עם סרטן מתקדם של הריאות מסוג תאים לא קטנים (NSCLC) (שלב IIIB-IV) ממרץ 2011 עד ינואר 2014. המטופלים חולקו לקבוצת היפרתרמיה בשילוב עם כימותרפיה (HCT) ולקבוצת כימותרפיה (CT). קבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) טופלה במשטר גמציטאבין (gemcitabine) וציספלטין (cisplatin) (GP) בשילוב עם היפרתרמיה אזורית עמוקה בתדרי-רדיו (regional radiofrequency deep hyperthermia), בעוד שקבוצת הכימותרפיה (CT) טופלה במשטר GP (gemcitabine and cisplatin) בלבד. אלה עם תפליט פלאורלי ממאיר עברו בנוסף ניקור חזה (thoracentesis) וכימותרפיה בהזרקה תוך-פלאורלית (intrapleural injection) עם או ללא שילוב היפרתרמית. תוצאות הטיפול הקליניות ותופעות הלוואי הושוו ונותחו לאחר הטיפול. תוכנת SPSS 19.0 (SPSS Inc., USA) שימשה עבור עיבוד נתונים סטטיסטיים. ערכי P הנמוכים מ-0.05 התקבלו כמובהקים סטטיסטית.
תוצאות – מתוך 93 המטופלים, קבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) כללה 48 מטופלים (16 מטופלים עם תפליט פלאורלי ממאיר), קבוצת הכימותרפיה (CT) כללה 45 מטופלים (10 מטופלים עם תפליט פלאורלי ממאיר). לא היה הבדל משמעותי בין שתי הקבוצות במאפייני המטופלים. שיעור התגובה הכולל (overall response rate) של תפליטים פלאורליים היה הרבה יותר טוב בקבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) מאשר בקבוצת הכימותרפיה (CT) (81.2% לעומת 40.0%, P = 0.046). לחולים בקבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) היה שיעור היארעות נמוך יותר של חולשה (12.5% לעומת 46.7%, P < 0.001, χ2 = 13.16) ולתופעות לוואי של מערכת העיכול (25.0% לעומת 77.8%, χ2 = 25.88, P < 0.001) מאשר בקבוצת הכימותרפיה (CT). התגובה האובייקטיבית של הגידול (objective tumor response) וההישרדות לא הראו הבדלים משמעותיים.
מסקנות – היפרתרמיה בשילוב עם כימותרפיה עשויה להוביל לפיתוח אסטרטגיה טיפולית טובה יותר עבור חולי סרטן מתקדם של הריאות מסוג תאים לא קטנים (NSCLC) עם תפליט פלאורלי ממאיר. כמו כן, זה יכול להפחית במידה ניכרת את ההשפעות הרעילות של כימותרפיה בהיארעות של חולשה ותופעות לוואי של מערכת העיכול בחולי סרטן מתקדם של הריאות מסוג תאים לא קטנים (NSCLC).
מבוא
סרטן ריאות הוא הגורם השכיח ביותר למקרי מוות הקשורים לסרטן ברחבי העולם. לחולים עם סרטן ריאות יש סיכויי הישרדות עגומים, עם שיעור הישרדות של 5 שנים של 17.1% בלבד, והשיעור גרוע בהרבה עבור חולים אלו עם מחלה בשלב IV, המהווה רק 3.6%. סרטן הריאות מסוג תאים לא קטנים (NSCLC) היווה יותר מ-85% מכלל מקרי סרטן הריאות. רוב החולים עם סרטן הריאות מסוג תאים לא קטנים (NSCLC) מציגים מחלה מתקדמת ושאינה ניתנת לניתוח (בשלב IIIB או IV). היעילות של טיפול כירורגי עבור סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם היא תמיד התווית נגד בעקבות מצבם הירוד של המטופלים או נוכחותם של נגעים גרורתיים מרובים.
לאחרונה, טיפול בהיפרתרמיה הפך לשיטה חשובה עבור חולי סרטן הריאות מסוג תאים לא קטנים (NSCLC), מכיוון שהיא יכולה לא רק לגרום לציטוטוקסיות ישירה (direct cytotoxicity) לתאים סרטניים, אלא גם למשל סנסיטייזר לכימותרפיה (chemosensitizer) וסנסיטייזר להקרנות (radiosensitivity). היפרתרמיה עשויה להגביר את פרפוזית הגידול וניתן להשתמש בה כדי לשפר את מתן התרופות. במקביל, החמצון המוגבר בגידול צפוי להגביר את רדיוסנסיטיזציה. מחקרים רבים הצביעו על כך שלהיפרתרמיה, כימותרפיה והקרנות גרמו להשפעה סינרגטית בטיפול בסרטן המעי הגס, סרטן הראש והצוואר מתקדם, סרטן הערמונית, סרטן השחלות, סרטן הוושט וסרטן הריאות. כימותרפיה היא טיפול חשוב עבור סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם ויכולה לשפר את ההישרדות הכוללת של החולים. גמציטאבין (Gemcitabine) בתוספת ציספלטין (cisplatin) (GP) הוא המשטר הכימותרפי הסטנדרטי קו ראשון עבור סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם. גמציטאבין (Gemcitabine) הוא אנלוג של נוקלאוזידים (nucleoside analog) בעל מנגנון פעולה ייחודי, המספק מגוון רחב של פעילות אנטי-סרטנית. ציספלטין (cisplatin) משרה היווצרות של קישורים צולבים תוך-גדיליים ובין-גדיליים (intra- and inter-strand cross links), מה שגורם שברים דו-גדילים ב-DNA (strand breaks) בשכפול של התאים. גמציטאבין (Gemcitabine) בשילוב עם ציספלטין (cisplatin) משמש כיום כמשטר קו ראשון עבור סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם. משטר זה קשור להישרדות ללא התקדמות (progression-free survival) משמעותית של חולי סרטן ריאות מסוג תאים לא קטנים (NSCLC) בהשוואה לאלה שטופלו בפקליטקסל (paclitaxel) וציספלטין (cisplatin). אבל משטר GP גורם בסבירות גבוהה יותר לתופעות לוואי בדרגה 3/4, כגון, המטולוגית, רעילות כלייתית ותופעות לוואי במערכת העיכול.
לפיכך, מחקר זה נועד להעריך את היעילות הקלינית והבטיחות של שילוב גמציטאבין (Gemcitabine), ציספלטין (cisplatin) והיפרתרמיה לטיפול בחולים עם סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם.
שיטות
אישור אתי
מחקר זה אושר על ידי הוועדה לבחינת אתיקה של מחקרים הכוללים נבדקים אנושיים של האוניברסיטה הרפואית של שנחאי (Shanxi Medical University). מכל מטופל התקבלה הסכמה מדעת בכתב.
מאפייני המטופלים
החוקרים העריכו באופן רטרוספקטיבית את הרשומות הרפואיות של 93 מטופלים עם סרטן מתקדם של הריאות מסוג תאים לא קטנים (NSCLC) שאינם ניתנים לניתוח ממרץ 2011 עד ינואר 2014 מהמחלקה לאונקולוגיה, בבית החולים הראשון של האוניברסיטה הרפואית שנחאי (First Hospital of Shanxi Medical University). כל המטופלים טופלו בכימותרפיה (גמציטאבין וציספלטין) בשילוב עם טיפול בהיפרתרמיה או ללא היפרתרמיה. קריטריונים נוספים להכללה היו כדלקמן: (1) מקרים מתועדים היסטולוגית או ציטולוגית עם סרטן ריאות מסוג תאים לא קטנים (NSCLC) בשלב IIIB או IV; (2) סטטוס תפקודי (performance status) לפי Eastern Cooperative Oncology Group (ECOG) של 0 עד 2; (3) ללא כימותרפיה או טיפולי הקרנות קודמים; (4) תפקוד תקין של איברים פנימיים עיקריים; (5) חולי סרטן ריאות מסוג תאים לא קטנים (NSCLC) עם תפליט פלאורלי ממאיר, אך ללא גרורות במוח; וכן (6) חולים עם הטיפול התומך הטוב ביותר, לפחות עד להתקדמות המחלה. המידע הבא על המטופלים התקבל מתרשימים של המטופלים, לרבות גיל, מגדר, סטטוס תפקודי, תת-סוג היסטולוגי, שלב הגידול, סוג הטיפול והתגובה הקלינית לטיפול. חולים אלה חולקו לקבוצות באופן הבא: (א) קבוצת היפרתרמיה בשילוב עם כימותרפיה (HCT), כללה 48 מטופלים, כאשר 16 מטופלים היו עם תפליט פלאורלי ממאיר. כל המטופלים הללו קיבלו כימותרפיה מסוג גמציטאבין (gemcitabine) וציספלטין (cisplatin) עם היפרתרמיה עמוקה בגלי-רדיו (radio-frequency deep hyperthermia). בנוסף, מטופלים עם תפליט פלאורלי ממאיר עברו ניקור חזה (thoracentesis) וכימותרפיה בהזרקה תוך-פלאורלית (intrapleural injection). (ב) קבוצת הכימותרפיה (CT) כללה 45 מטופלים, וביניהם, היו 10 מטופלים עם תפליט פלאורלי ממאיר. מטופלים אלה קיבלו כימותרפיה מסוג גמציטאבין (gemcitabine) וציספלטין (cisplatin). אף אחד מהם לא עבר היפרתרמיה בלבד.
שיטות טיפול
כימותרפיה
טיפול כימותרפי תוך ורידי סטנדרטי עם גמציטאבין (gemcitabine) וציספלטין (cisplatin) ניתן כל 3 שבועות. רמות המינון של 1000 מ"ג/מ"ר של גמציטאבין בימים 1 ו-8, ו-75 מ"ג/מ"ר של ציספלטין חולקו ל-2 עד 4 ימים וניתנו בכל מחזור. טופיסטרון (Tropisetron) ותרופות דומות אחרות ניתנו באופן שגרתי כדי להפסיק את ההקאות במהלך הכימותרפיה.
היפרתרמיה
היפרתרמיה יושמה על ידי מערכת היפרתרמיה עמוקה בגלי-רדיו HY7000-I (Nanjing GREATHOPE Corporation, Nanjing, China), אשר מחממת את הנגעים המקומיים-אזוריים הנמצאים עמוק בתוך הגוף. היפרתרמיה בוצעה לפני או אחרי כימותרפיה פעמיים בשבוע או לאחר כימותרפיה בהזרקה תוך-פלאורלית (intrapleural injection). החום ניתן באמצעות שימוש בהיפרתרמיה אזורית קיבולית (RF-capacitive) בגלי רדיו של 40.68 ± 1.00 MHz. משך החימום הותאם מ-40 ל-60 דקות בהתבסס על סבילות המטופל (חציון, 50 דקות). שתי האלקטרודות העליונות והתחתונות או השמאליות והימניות היו בקוטר של 30 ס"מ והונחו בצדדים מנוגדים של כל אזור בית החזה, והאלקטרודות שימשו לחלופין להפחתת רמת הכאב הנגרם על ידי חימום. מטרת הטיפול בהיפרתרמיה הייתה להשיג טמפרטורת עור של 40 מעלות צלזיוס. החולה שכב בתנוחת פרקדן (supine position) וטמפרטורת הגוף חזרה לעצמה באופן טבעי. המטופלים הונחו בקפידה לציין על כל תחושה בלתי נעימה, דבר שעלול לרמז על נקודה חמה (hot spot).
כל המטופלים שנכללו קיבלו 6 טיפולי הקרנות על-ידי MV-X ray מאיץ קווי עם קרינה בעלת בעוצמה מאופננת IMRT (linear accelerator intensity modulated) , ושלבי הטיפול היו כדלקמן: 1) המטופלים הוצבו וקובעו, נסרקו ומוקמו באמצעות עם CT סימולטור (Philips, Brilliance, Netherlands and Siemens, AS Definition Open20, Germany) והמרווח של שכבות הסריקה היה 3 מ"מ. 2) תיחום היעד: החוקרים השתמשו במערכת תכנון טיפול 13.6 (Treatment planning system-TPS) (Varian, Vitalbeam, USA) וב-Raystaion4.7.5 (Varian, Trilogy, USA and Elekta, Precise, UK) על מנת להגדיר את נפחי היעד לפי דו"ח ICRU מספר 83, אזור היעד כלל: 1-נפח גולמי של הגידול (GTV-gross tumor volume): טווח הנגעים הראשוניים שנקבעו על פי הדמיה, לרבות נגעי ריאות ראשוניים (GTV) וגרורות אזוריות בבלוטות הלימפה (GTVnd).2 -נפח הגידול הקליני (CTV-Clinical tumor volume): הוא כלל את ה-GTV, נגעים תת-קליניים ואזורים שהגידול עלול לחדור אליהם. 3-תכנון נפח הגידול (PTV-Planning tumor volume) היה הטווח שנקבע בהתאם לתנועת האיברים ושגיאת הצבת מיקום יומית כדי להבטיח את מינון הטיפול.4- איברים בסיכון: איברים בסיכון כללו: הריאה השמאלית, הריאה הימנית, 2 הריאות, לב, טרכאה, הוושט, גזע המוח, חוט השדרה, העצב האופטי, כיאזמה אופטית וכו'. 3) על פי הנחיות ה-NCCN, בו ניתנו מינון המנה והמגבלות של האיברים בסיכון והמגבלה המסכנת את האיברים, והתוכנית הוערכה: 1- מנת הטיפול: רדיותרפיה רדיקלית לנגעי ריאה: PGTV: 60gy-66Gy/30-33 f, PTV1: 50-54Gy/ 30-33פרקציות, ב5 פרקציות בשבוע במהלך תקופה של 6-7 שבועות. SBRT: 60Gy/10f. רדיותרפיה פליאטיבית לנגעים בריאות: PGTV: 45-50Gy, PTV1: 36-40Gy/ 25-27 פרקציות. נגעים אחרים כגון הקרנות בכל המוח, בגוף חוליה ובעצם: PTV: 30Gy / 10f או 40Gy/20f. 2- מגבלת איברים בסיכון (OAR-Organ at risk): המינון המרבי של גזע המוח היה פחות מ-54Gy; המנה המקסימלית של חוט השדרה < 45Gy; המנה המקסימלית של העצב האופטי והכיאזמה האופטית < 50Gy; ריאה בודדת V5 ≤ 65%, V20 ≤ 30%, V30 ≤ 20%; לב V30 ≤ 30%, מינון קרינה ממוצע של הלב ≤ 35Gy; הוושט V50 ≤ 50%, מנה ממוצעת ≤ 34 Gy. המנה המקסימלית של הטרכיאה הייתה פחות מ-60 Gy
כימותרפיה בהזרקה תוך-פלאורלית (intrapleural)
ניקור חזה (thoracentesis) וצנתר ורידי מרכזי בוצעו תחת מיקום אולטראסוני (ultrasonic location) מסוג B, ובאמצעותו נוקז התפליט הפלאורלי ככל האפשר. אינטרלוקין-2 (Interleukin-2) הומס ב-50 מ"ל של תמיסת מלח רגילה (normal saline) להזרקה תוך-פלאורלית. על מנת לשפר את הזמינות הביולוגית (bioavailability) של התרופה, נדרשו המטופלים להתהפך אחת ל-15 דקות על מנת להבטיח גישה מלאה לתרופות בתוך דופן בית החזה. המינונים ניתנו פעמיים בשבוע למשך 4 שבועות בממוצע. נרשמה תגובה מפורטת לטיפול, בדיקת אולטרסאונד מסוג B (B-type ultrasonic) נבחנה מחדש מדי שבוע.
הערכת היעילות
קריטריונים להערכת התגובה בגידולים מוצקים (RECIST) 1.1, שימשו כדי להעריך את התגובה. תגובה מלאה (complete response) הוגדרה כהיעלמות של כל נגעי המטרה למשך 4 שבועות לפחות. עבור תגובה חלקית (partial response), נדרשה ירידה של לפחות 30% בסכום הקטרים החד-ממדיים (unidimensional diameters) הגדולים ביותר של הנגעים הממוקדים, תוך התייחסות לסכום הבסיס של הקטרים (baseline sum of diameters) של נגעי המטרה. מחלה מתקדמת (Progressive disease) הצריכה עלייה של לפחות 20% בסכום הקטרים של נגעי המטרה, תוך לקיחת הסכום הקטן ביותר מבין הקטרים של נגעי המטרה שנרשמו מאז תחילת הטיפול כהתייחסות. כל המקרים שאינם מתאימים לתגובה חלקית (PR) או למחלה מתקדמת (PD) מסווגים כמחלה יציבה (stable disease). הקריטריונים של ארגון הבריאות העולמי להערכת השפעות טיפוליות בחולים עם גידולים מוצקים שונו על מנת להעריך את תוצאות הטיפול בתפליט פלאורלי ממאיר, כולל תגובה מלאה (CR): היעלמות התפליט והיעלמות הסימפטומים, ושמירה על יציבות במשך יותר מ-4 שבועות; תגובה חלקית (PR): התפליט הצטמצם ב-50%, התסמינים השתפרו, והתפליט שנותר לא הראה גדילה במהלך 4 שבועות של תצפית; מחלה יציבה (SD): התפליט הפלאורלי ירד בפחות מ-50% או לא הראה שינוי; ומחלה מתקדמת (PD): התפליט פלאורלי היה גדול מבעבר. תגובה מלאה (CR) ותגובה חלקית (PR) סוכמו כשיעור תגובה אובייקטיביים (ORR). שיעור בקרת המחלות (Disease control rate) הכיל תגובה מלאה (CR), תגובה חלקית (PR) ומחלה יציבה (SD). ההישרדות ללא התקדמות (PFS) חושבה מיום הטיפול ועד לתיעוד של התקדמות המחלה או עד למוות. ההישרדות הכוללת (Overall survival) הוגדרה מיום הטיפול ועד למוות או עד ליום האחרון של המעקב. הרעילויות סווגו כדרגות 0 עד 4 על פי תקן ארגון הבריאות העולמי (WHO), למעט הרעילות הקשורה להיפרתרמיה של כוויות בעור.
ניתוח סטטיסטי
תוכנת SPSS 19.0 (IBM Corp., Armonk, NY, USA) שימשה לעיבוד נתונים סטטיסטיים. הפרופורציות הושוו על ידי מבחן כי-בריבוע (Chi-squared) והמבחן המדויק של פישר (Fisher exact probability). זמן ההישרדות הכוללת הוערך בשיטת קפלן-מאייר (Kaplan-Meier). עקומות ההישרדות הושוו באמצעות מבחן לוג-הדרגות (log-rank). ערכי P הנמוכים מ-0.05 נתפסו כמובהקים סטטיסטית.
הערכת איכות חיים הקשורה לבריאות (HRQoL)
איכות חיים הקשורה לבריאות (HRQoL) הוערכה בנקודת ההתחלה ובחודש, חודשיים ו-3 חודשים לאחר הטיפול, באמצעות הגרסה הקוריאנית של שאלון איכות החיים של הארגון האירופי לחקר וטיפול בסרטן C-30 (EORTC QLQ-C30) וההערכה הפונקציונאלית של טיפול בסרטן–כבד ודרכי מרה גרסה 4.0 (FACT-Hepatobiliary v4.0). בזמן הערכת איכות החיים הקשורה לבריאות (HRQoL), סטטוס הכאב הנוכחי הוערך גם עם הסולם האנלוגי חזותי (VAS-visual analog scale) עבור כאב.
מעקב והערכת רעילות
הערכת המעקב הראשונה תוכננה להתקיים חודש אחד לאחר הטיפול הקרינתי לכל הכבד (WLI) עם טיפול בהיפרתרמיה, ולאחר מכן כל חודש למשך 3 חודשים. בכל הערכת מעקב, עברו המטופלים בדיקות קליניות ובדיקות גופניות. הוערכו איכות חיים הקשורה לבריאות (HRQoL), סולם אנלוגי חזותי (VAS) לכאב ואנטיגן קרצינואמבריוני (Carcinoembryonic Antigen – CEA). בוצעה סריקת טומוגרפיה ממוחשבת (CT), ונבדק פרופיל כימיה (chemistry profiling) כולל תפקודי כבד.
רמות הרעילות הוערכו באמצעות הקריטריונים הטרמינולוגיים המשותפים לתופעות לוואי גרסה 4.0 (Common Terminology Criteria for Adverse Events).
ניתוח סטטיסטי
ניסוי זה תוכנן כמחקר פאזה שנייה. החוקרים תכננו לגייס 47 מטופלים על מנת לצפות בשיעור של 50% בפליאציה של הסימפטומים (symptom palliation rate), שהוגדרה כתגובת כאב מלאה (pain response) או חלקית במעקב של חודש אחד לאחר הטיפול הקרינתי לכל הכבד (WLI) עם היפרתרמיה. המחקר נאמד כבעל עוצמה סטטיסטית (power to detect) של 80% לזהות הבדל של 20% מטיפול קרינתי לכל הכבד (WLI) בלבד ברמת מובהקות דו-צדדית של 5%. תגובת הכאב, כנקודת הקצה העיקרית, הוערכה במעקב של חודש אחד עם קריטריונים של קבוצת הקונצנזוס הבינלאומי לגרורות בעצמות IBMCG (Bone Metastases Consensus) (טבלה משלימה 2).
להלן טבלה משלימה 2: The International Bone Metastases Consensus Group criteria

תגובות אובייקטיביות הוערכו במעקב של חודש אחד לפי הקריטריונים המעודכנים להערכת תגובה בגידולים מוצקים (Response Evaluation Criteria in Solid Tumors v1.1). מדידות חוזרות של ניתוח שונות חד כיווני (ANOVA-Analysis of variance) שימוש על מנת לקבוע שינויים באיכות החיים הקשורה לבריאות (HRQoL). התפלגויות של משתני זמן עד למאורע (time-to-event) נאמדו באמצעות שיטת קפלן-מאייר (Kaplan-Meier product-limit method) והושוו באמצעות מבחן לוג הדרגות (log-rank test). הישרדות ללא התקדמות מקומית (Local progression-free survival), המוגדרת כהתקדמות בתוך הכבד על פי RECIST v1.1 והישרדות ללא התקדמות הכאב (pain progression-free survival), המוגדרת כהתקדמות על פי הקריטריונים של IBMCG, חושבו מתאריך התחלת הטיפול הקרינתי לכל הכבד (WLI) ועד למועד התפתחות האירוע (event developed) או ביקור המעקב האחרון.
תוצאות
מאפייני המטופלים
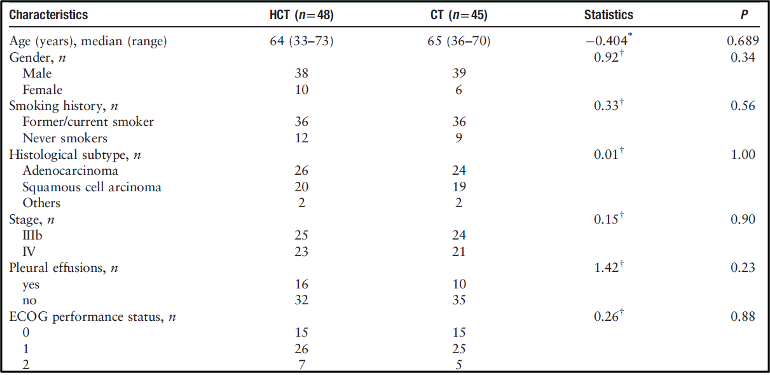
המחקר כלל 93 מטופלים, כאשר 48 מטופלים קיבלו היפרתרמיה וכימותרפיה, ו-45 מטופלים קיבלו כימותרפיה בלבד. לא היה הבדל משמעותי בין שתי הקבוצות בגיל, מגדר, הרגלי עישון, סטטוס תפקודי, שלב המחלה וההיסטולוגיה של הגידול. הגיל החציוני של המטופלים היה 64 בקבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) ו-65 בקבוצת הכימותרפיה (CT), בהתאמה. כ-80% מהמטופלים היו גברים, וכ-80% היו בעלי הרגלי עישון. לכמעט מחצית מהמטופלים היה ציון סטטוס תפקודי של 1, וכ-20% עד 30% סבלו מתפליט פלאורלי ממאיר [טבלה 1].
להלן טבלה 1: מאפייני המטופלים של 2 קבוצות המחקר של מטופלים עם סרטן ריאות מסוג תאים לא קטנים (NSCLC)
תגובה אובייקטיבית של הגידול (Objective tumor response) והישרדות
בקבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT), המספר הממוצע של מחזורי כימותרפיה היה 3.5 ± 0.3, והיפרתרמיה בגלי רדיו הייתה שמונה פעמים עבור מקרה. אף מטופל לא השיג תגובה מלאה (CR), 18 (37.5%) מטופלים הראו תגובה חלקית (PR), ל-16 (33.3%) הייתה מחלה יציבה (SD), ו-14 (29.2%) מטופלים סבלו ממחלה מתקדמת (PD). שיעור התגובה הכוללת (ORR) עמד על 37.5%, ושיעור בקרת המחלה (DCR) היה 70.8%. בקבוצת הכימותרפיה (CT), המספר הממוצע של מחזורי הטיפול היה 2.8 ± 0.4, לא נצפה תגובה מלאה (CR), ל-15 (33.3%) מטופלים הייתה תגובה חלקית (PR), ל-15 (33.3%) מטופלים הייתה מחלה יציבה (SD) ו-15 (33.3%) מטופלים סבלו ממחלה מתקדמת (PD). שיעור התגובה הכוללת (ORR) עמד על 33.3%, ושיעור בקרת המחלה (DCR) היה 66.7%.
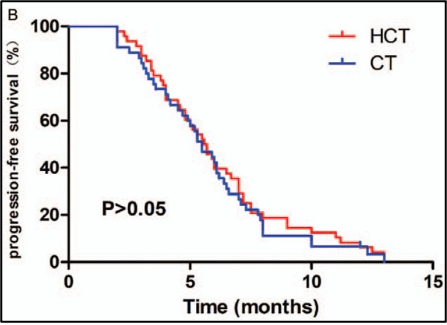
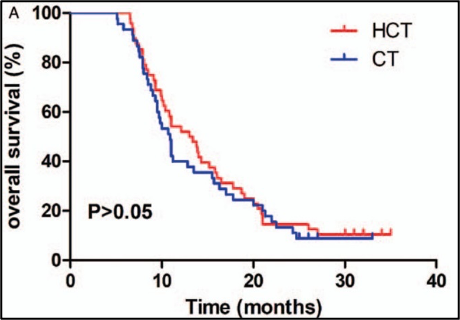
המעקב נע בין 5 ל-35 חודשים (חציון, 11.0 חודשים). בקבוצות ההיפרתרמיה בשילוב עם כימותרפיה (HCT) ובקבוצת הכימותרפיה (CT), שיעור ההישרדות לאחר שנה היה 54% ו-40%, והשיעור לאחר שנתיים היה 14.6% ו-13.3%, בהתאמה. חציון הישרדות ללא התקדמות (PFS) היה 5.65 ו-5.5 חודשים, ההישרדות הכוללת (OS) החציונית הייתה 13.2 ו-10.9 חודשים, בהתאמה. לא נמצאו הבדלים משמעותיים בתגובה האובייקטיבית של הגידול ובהישרדות [טבלה 2, איור 1].
להלן טבלה 2: השוואות של אפקט הריפוי (curative effect) של 2 קבוצות המחקר של מטופלים עם סרטן ריאות מסוג תאים לא קטנים (NSCLC)

להלן איור 1: (A) הערכות קפלן-מאייר להישרדות הכוללת (OS), (B) הערכות קפלן-מאייר להישרדות ללא התקדמות (PFS)
השפעות רעילות
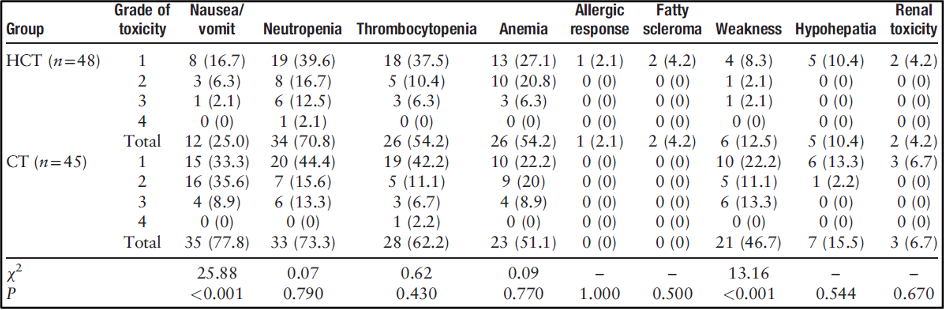
ההשפעות הרעילות מוצגות בטבלה 3. לא היה הבדל בין שתי הקבוצות ברעילות המטולוגית, הפרעה בתפקודי הכבד, רעילות כלייתית וכן בתגובה אלרגית. אצל שני מטופלים, נצפתה סקלרומה שומנית (fatty scleroma) לאחר היפרתרמיה ונעלמה באופן ספונטני. הבדל משמעותי נצפה בהיארעות של חולשה (12.5% ו-46.7%, χ2 = 13.16, P = 0.0003) ותגובות של מערכת העיכול (25.0% ו-77.8%, χ2 = 25.88, P < 0.0001) בין קבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) לבין קבוצת הכימותרפיה (CT).
להלן טבלה 3: השוואות של רעילות ותופעות לוואי של המטופלים בשתי הקבוצות עם סרטן ריאות מסוג תאים לא קטנים (NSCLC)
הערכת התגובה של תפליטים פלאורליים
החוקרים ניתחו את הערכת התגובה של תפליטים פלאורליים בין שתי הקבוצות לאחר חציון של 3.5 מחזורים טיפול (טווח 2-6). בקבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT), ארבעה מטופלים (25.0%) היו במצב תגובה מלאה (CR), תשעה מטופלים (56.3%) היו במצב תגובה חלקית (PR), שני מטופלים (12.5%) היו במצב של מחלה יציבה (SD), ומטופל אחד (6.3%) סבל ממחלה מתקדמת (PD). שיעור התגובה הכולל (ORR) עמד על 81.2%. בקבוצת הכימותרפיה (CT), אף מטופל לא הגיע לסטטוס של תגובה מלאה (CR), ארבעה מטופלים (40.0%) הגיעו למצב של תגובה חלקית (PR), ארבעה מטופלים (40.0%) הגיעו למצב של מחלה יציבה (SD), ושני מטופלים (20.0%) היו עם סטטוס של מחלה מתקדמת (PD). שיעור התגובה הכולל (ORR) עמד על 40.0%. היה הבדל משמעותי בין שתי הקבוצות (P = 0.046) [טבלה 4].
להלן טבלה 4: השוואות של ההשפעה המרפאת של תפליטים פלאורליים בשתי הקבוצות

דיון
היפרתרמיה היא אסטרטגיית טיפול חשובה לגידולים ממאירים מתקדמים, ודווחה כמשפרת את היעילות הטיפולית בגידולים מסוימים כגון סרטן הערמונית, סרטן השחלות, סרטן פי הטבעת וסרקומה של רקמות רכות, באמצעות פעולה סינרגטית עם טיפולי הקרנות וכימותרפיה. למרות שהמנגנונים המולקולריים המדויקים עדיין קשים להגדרה, כמה מחקרים הדגימו כי היפרתרמיה עלולה להוביל לנזק בדנ"א התאי, בחלבון ובממברנה, ולהפריע למחזור התא, כמו גם לסינתזת ה-DNA והחלבונים. כל אלה עלולים לגרום למוות של תאים, בין אם באופן ישיר או על ידי הפעלת המסלולים האפופטוטיים (apoptotic pathways). באופן מעניין, היפרתרמיה עלולה לעכב את תיקון הדנ"א, ויכולה לגרום לרגישות של התאים הסרטניים לחומרים המזיקים לדנ"א, כגון גמציטאבין (gemcitabine), אנלוגים של פירימידין (pyrimidine analog), ציספלטין (cisplatin), ציקלופוספאמיד (cyclophosphamide), מלפלן (melphalan), קמפטוטצין (camptothecin), מעכבי PARP-אולפאריב (Olaparib), PJ-34 וכן הלאה. מחקרים נוספים העלו כי היפרתרמיה יכולה להעלות את הפעילות של quinone oxidoreductase (NQO1) בגידולים כדי לשפר את הציטוטוקסיות של β-lapachone נגד תאים סרטניים הן במבחנה (in vitro) והן in vivo. יתר על כן, היפרתרמיה עשויה להגביר את רדיוסנסיטיזציה על ידי דיכוי פעילות DNA-PK קינאז (kinase) והיעדר מסלול תיקון DNA לא הומולוגי (nonhomologous end joining) ו/או מסלול רקומבינציה הומולוגית (homologous recombination) במהלך מסלול לתיקון שברים דו-גדילים (double strand break repair). מנקודת מבט קלינית, Ohguri ואח’, דיווחו כי טיפול בהקרנות בשילוב עם היפרתרמיה אזורית הדגימו תוצאות קליניות טובות יותר במטופלים עם סרטן ריאות מסוג תאים לא קטנים (NSCLC) בשלב III. עבור מטופלים עם הישנות של סרטן ריאות מסוג תאים לא קטנים (NSCLC), הקרנה חוזרת (re-irradiation) בתוספת של היפרתרמיה אזורית עשויה להיות טיפול מבטיח התורם לשליטה מקומית טובה יותר ולרעילות מוסכמת. במחקר רב-מרכזי אקראי בפאזה 3, כימותרפיה ניאו-אדג'ובנטית עם היפרתרמיה אזורית הביאה להישרדות ללא התקדמות מקומית (LPFS) ולהישרדות ללא מחלה (disease free survival) טובים יותר באופן משמעותי עבור מטופלים עם סרקומה מקומית של רקמות רכות בסיכון גבוה (localized high-risk soft-tissue sarcoma) מאשר כימותרפיה ניאו-אדג'ובנטית בלבד. דוסטאקסל (Docetaxel) בשילוב עם זילוף של כימותרפיה היפרתרמית תוך-צפקית (intraperitoneal hyperthermic perfusion) יכול לשפר ביעילות את השיעור האפקטיבי הכולל (total effective rate) בשליטה על שיעור המיימת (ascites), שיעור ההפוגה של הגידול ושיעור הירידה של CA125 בחולות עם סרטן שחלות מתקדם.
למיטב ידיעת החוקרים, זהו אחד המחקרים הרטרוספקטיביים הבודדים שכללו כימותרפיה והיפרתרמיה בשילוב עם כימותרפיה במטופלים עם סרטן הריאות מסוג תאים לא קטנים (NSCLC) מתקדם. התוצאות של החוקרים במחקר הנוכחי הצביעו על כך שהיפרתרמיה בשילוב עם כימותרפיה לטיפול בסרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם, הדגימו מגמות טובות יותר בתגובה האובייקטיבית של הגידול ובתוצאות הקליניות, אך לא הראו הבדל מובהק. לפיכך, יש צורך בקבלת יותר מקרים במחקרים הבאים עבור כימותרפיה (CT) ועבור היפרתרמיה בשילוב עם כימותרפיה (HCT) בחולים עם סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם. עם זאת, החוקרים גילו כמה תוצאות מעניינות, שכן נמצא הבדל מובהק בהיארעות של חולשה ושל תגובות במערכת העיכול, בין קבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) לבין קבוצת הכימותרפיה (CT). היפרתרמיה כטיפול פיזיותרפי יכולה להרגיע את המטופלים ולקדם חילוף חומרים. על פי מחקר, ההשפעה ההיפרתרמית של אגוניסטים לא סלקטיביים של 5-HT הייתה עוברת אנטגוניזם תלוי-מינון על ידי אנטגוניסטים לקולטן 5-HT ואנטגוניסט לקולטן דופמין ספיפרון (spiperone), כך שהיפרתרמיה עשויה להיות בקורלציה למשהו שרלוונטי לרגשות ובחילות. החוקרים שיערו כי היפרתרמיה עשויה גם לשפר את היעילות הטיפולית של תרופות נוגד-הקאות (antiemetics), כגון מטוקלופראמיד (metoclopramide), טופיסטרון (Tropisetron) ואונדנסטרון (ondansetron), או שיכולה לעכב את הפרשת סרוטונין (5-hydroxytryptamine) ונוירוקינין-1 (neurokinin-1). באופן כללי, זה תמך במטופלים לקבל מינון מלא וקורס מלא של כימותרפיה.
תפליט פלאורלי ממאיר (malignant pleural effusion) מתרחש לעיתים קרובות בסרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם, גורם להיחלשות של התפקוד הראיתי, ופוגע באיכות החיים עקב תסמינים כמו קוצר נשימה, כאב, שיעול וכו'. במחקר זה החוקרים גילו כי היפרתרמיה האזורית בשילוב עם הזרקה תוך-פלאורלית של אינטרלוקין-2 (interleukin-2) היו אחד האמצעים היעילים לניהול תפליט פלאורלי, עם שיעור תגובה כולל (ORR) של 81.2% בקבוצת ההיפרתרמיה בשילוב עם כימותרפיה (HCT) בהשוואה ל-40% בקבוצת הכימותרפיה (CT). לא התרחשו אירועים של סיבוכים משמעותיים, כגון אירועים נשימתיים וחום. לא היו סיבוכים קלים, למעט הכאבים באתרי החדרת צינור החזה. ייתכן שהסיבה לכך היא שההיערכות של שני אלה יכול לגרום לביטוי חזר של חלבון עקת חום 70 (heat-shock protein), תאי T CD8 ו-CD4 חיוביים, לקדם אפופטוזיס ונמק (necrosis) של תאי גידול ולאחר מכן להפחית היווצרות של תפליט פלאורלי ממאיר. היפרתרמיה יכולה גם לקדם חדירתם של תרופות כימותרפיות לתוך חלל הפלאורה (pleural cavity).
לסיכום, היפרתרמיה בשילוב עם כימותרפיה עשויה להוביל לפיתוח של אסטרטגיה טיפולית טובה יותר בחולי סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם, עם תפליט פלאורלי ממאיר. כמו כן, זה יכול להפחית במידה ניכרת את ההשפעות הרעילות הכימותרפיות בהיארעות של חולשה ותופעות לוואי במערכת העיכול בחולי סרטן ריאות מסוג תאים לא קטנים (NSCLC) מתקדם. עם זאת, מחקר זה היה מחקר רטרוספקטיבי הכולל מידע על מוסד בודד, וכמו כן בעל גודל מדגם קטן. יש צורך במחקרים נוספים על מנת לאשש את ממצאי המחקר הנוכחי של החוקרים.



