
Hyperthermia combined with radiation therapy for superficial breast cancer and chest wall recurrence: A review of the randomised data
Timothy M. Zagar1, James R. Oleson1, Zeljko Vujaskovic1, Mark W. Dewhirst1, Oana I. Craciunescu1, Kimberly L. Blackwell2, Leonard R. Prosnitz1, and Ellen L. Jones3
- Department of Radiation Oncology, Duke University Medical Centre, Durham, North Carolina
- Department of Medicine, Division of Medical Oncology, Duke University Medical Centre, Durham, North Carolina
- Department of Radiation Oncology, University of North Carolina Cancer Hospital, Chapel Hill, North Carolina, USA
תקציר
היפרתרמיה מזה זמן רב משולבת יחד עם קרינה לטיפול בממאירות שטחיות, בין השאר בשל יכולות לעלות את התגובה לגירוי הטיפול ההקרנתי שלה (רדיוסנסיטיזציה). חולים הסובלים מהישנות שטחית של סרטן השד, בין אם באזור דופן בית החזה לאחר כריתת שד, או בשד לאחר הליך שימור שד, לרוב מדגימים תוצאות קליניות שליליות. לעתים קרובות מטופלים אלו מפתחים מחלה גרורתית. יחד עם זאת, אין אפשרות להתעלם מהבעיות הקשורות לכשל שליטה באזורים השטחיים. התחלואה היא עצומה ועלולה לפגוע משמעותית באיכות החיים. לא קיים תקן טיפולי מקובל של טיפול בהישנות שטחית של סרטן השד, בייחוד בחולים שעברו בעבר טיפולי קרינה. קיימת ספרות מהותית אודות השימוש בשילוב היפרתרמיה והקרנות לטיפול בהישנות שטחית מסוג זה. רוב הספרות הינה רטרוספקטיבית באופייה, אך ישנם מספר ניסויים אקראיים (randomised ) גדולים יותר בשלב III המראים שיעור טוב יותר בתגובה קלינית מלאה בחולים שטופלו בשתי השיטות. במאמר סקירה זה יודגשו הנתונים הפוטנציאליים החשובים שפורסמו בנוגע לשימוש משולב בהיפרתמיה ובקרינה בטיפול.
מבוא
חולים עם הישנות מחלת הסרטן של דופן החזה או סרטן השד הם קבוצה הטרוגנית, אך העיקרון המאחד הוא שהטיפול הסטנדרטי כשל בכולם. שיעור ההישנות המקומית לאחר כריתת שד נע בין 5% ל-45%, ובכך מעודד את השיקול של טיפולי קרינה משלימים.. הוכח כי השימוש ברדיותרפיה לאחר כריתת השד מפחיתה באופן משמועתי את הסיכון לכישלון ל-2% עד-15%, וכן מקדמת יתרון הישרדותי. אצל חולים אשר הטיפול המקומי אכן נכשל, סובלים מתחלואה שונה הכוללת כאב, כיבים, דימום, בצקת לימפתית (lymphoedema), פלקסופתיה ברכיאלית (brachial plexopathy), נוסף לכך מצוקה פסיכולוגית בשל מחלה מקומית גלויה. חלק ניכר מהחולים שחווים כשל בטיפול באזור קיר בית החזה יפתחו גם מחלה גרורתית מרוחקת, מה שיגרום לחלק מהמטפלים לטפל בחולים אלו עם הישנות מקומית באופן פליאטיבי. למרות זאת, עם טיפול מקומי אגרסיבי, אצל חלק מהחולים יכולים להיות מרווחי זמן ארוכים ללא הישנות המחלה. היפרתרמיה (HT) בהקשר הקליני כמגבירה רגישות של גידולים שטחיים להקרנות (radiosensitiser) לגידולים מוגדרת כטמפרטורות שהם מעל התנאים הפיזיולוגיים הנורמליים, בטווח בין 40-45 מעלות צלזיוס. הדיווח הראשוני על השימוש בהיפרתמיה בטיפול בסרטן השד היה לפני יותר מ-5000 שנה, שתואר על ידי פפירוס מצרי. בעידן המודרני, השימוש בהיפרתמיה בשילוב עם הקרנות מבוסס על מספר עקרונות ביולוגיים, כולל יכולת להשפיע על תאים בשלב ה-S, שלב במחזור התא שבו הקרינה פחות יעילה. בנוסף להיותה בעלת רעילות ישירה, היפרתרמיה יכולה לעכב תיקון נזקים תת-קטלניים ולשפר חמצון, ובכך להגביל את רמת ההיפוקסיה שמעכבת את יעילות ההקרנות. שימוש בהיפרתמיה כמעלה את יעילות הקרינה, מעצם ההגדרה, תפחית את מינון הקרינה הדרוש כדי לקבל את אותו האפקט כמו בהיעדרה; עניין החשוב במיוחד בקרב נשים שעברו טיפולי הקרנה לסרטן השד, כאשר עולה החשש מרעילות מוגברת של רקמות תקינות. יתר על כן, מינונים לטיפול במחלות באזורי גוף שהוקרנו בעבר לרוב מוגבלים יותר, מה שמגדיל את חשיבות רגישות הגידול.
חומרים שיטות
נתונים אקראיים
ישנם דיווחים רבים בספרות המפרטים את התוצאות של היפרתרמיה משולבת עם טיפולי הקרנות לקיר בית החזה/הישנות שטחית של סרטן השד. רבים מהם רטרוספקטיביים של מוסד יחיד, אך ישנם כמה ניסויים פרוספקטיביים אקראיים גדולים עם נקודה סופית ראשונית של אחוז השגת תגובה קלינית מלאה (טבלה א).
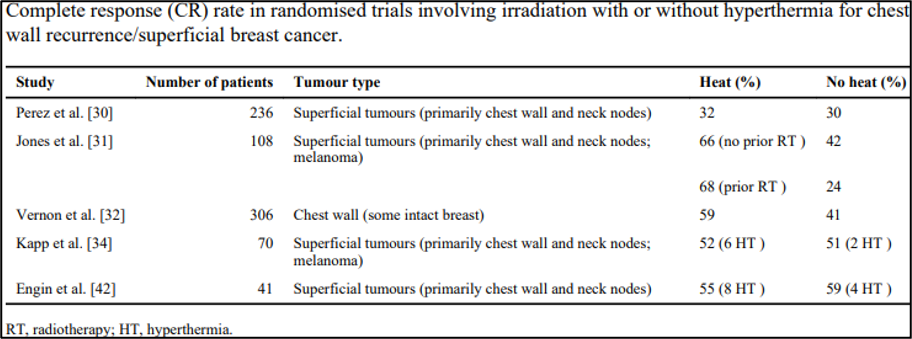
להלן טבלה א:
הניסוי האקראי הראשון נערך על ידי Radiation Therapy Oncology Group (RTOG), פרוטוקול 8104, וכלל 307 חולים עם גידולים שטחיים הניתנים למדידה. ל-245 מהם היה נגע בודד והיו זמינים לאנליזה. הטיפול שלהם כלל מינון קרינה של 32 גריי, שניתן ב-4 גריי פעמיים בשבוע, עם שני מפגשי היפרתרמיה (מטרה 42.5 מעלות צלזיוס, 45-60 דקות). כ-30% (68 חולים) מהנכללים סבלו ממחלה שטחית בשד או בדופן בית החזה. הנקודה הסופית העיקרית שלהם הייתה קצב התגובה המלאה, ובסך הכל, לא נמצאה עלייה סטטיסטית מובהקת בשליטה המקומית בהוספת חום לרדיותרפיה. בבדיקת תתי-קבוצות, חולים עם נגעים בשד או בקיר בית החזה או בגבולות האזורים היו עם שיעור של כ-62% בקצב התגובה המלאה בהוספת חום, לעומת 40% ללא. בנוסף, לחולים עם נגע בקוטר קטן מ-3 ס"מ היה שיעור התגובה המלאה 52% עם חום, לעומת 39% עם הקרנות בלבד (p = 0.02). הסתייגות של תוצאותיהם שצוינה, שאושרה במחקרים אחרים, הייתה איכות הטיפול שניתנה. רק 52% מהקבוצה של הטיפול המשולב (HT/RT) קיבלו מינון קרינה מלא ו-8 טיפולי היפרתרמיה; 42% ו-31% מהנגעים שקטנים מ3 ס"מ וגדולים מ-3ס"מ בהתאמה, קיבלו חימום "טוב", שהוגדרו כלפחות 4 טיפולי היפרתרמיה של 42.5 מעלות צלזיוס למשך 45 דקות בנקודת הציון של הטמפרטורה. החוקרים ציינו כי ההישרדות הנמוכה של המטופלים (22% בחיים בשנה), יכולה לסייע בהסבר שיעורי הבקרה הנמוכים שלהם, שכן חולים צריכים לשרוד מספיק זמן עבור השפעה קלינית מלאה על מנת להיות מוערכים בשתי להיות מוערך בשתי הזרועות. כל הרעילויות אוזנו באופן דומה בשתי הקבוצות, פרט לכך ש-30% מהחולים שקיבלו טיפול משולב פיתחו שלפוחיות תרמיות, לעומת 0% בקבוצה שקיבלה טיפול קרינה בלבד. לא הוזכרה חומרת הפגיעה התרמית, ולא שיטות הטיפול שננקטו במידת הצורך.
זמן קצר לאחר שRTOG 8104 החל לאסוף חולים, אוניברסיטאות סטנפורד ותומס ג'פרסון ניהלו ניסויים אקראיים של מוסד יחיד על מנת לענות על השאלה האם יש לתת טיפול אחד או שניים בהיפרתמיה מדי שבוע. שני הניסויים הללו, שכללו קבוצה הטרוגנית של חולים (בעיקר דופן בית החזה), לא מצאו הבדל בשיעור הקרינה אם היפרתרמיה ניתנה פעם או פעמיים בשבוע. הקרנות היו דומות בשני הניסויים להישנות בחזה שלא טופל בקרינה בעבר, אך כאשר חולים עם הישנות בדופן החזה נזקקו להקרנה חוזרת, החלוקה הייתה שונה. תומס ג'פרסון השתמש בטיפול הקרנתי במספר מקטעים מצומצם יותר Hypofractionation (40 Gy in 4 Gy fractions), ואילו סטנפורד השתמשו בחלוקה מסורתית יותר (21.6–36 Gy in 1.8–2 Gy fractions). שני הניסויים העריכו פרופילים תרמיים דומים ושניהם מצאו כי Tmin הוא הגורם התרמי המנבא היחיד לשליטה מקומית מתמשכת. הניסוי בסטנפורד מצא מגמת עלייה בשליטה המקומית עם Tmin ≥ 41°C, לעומת <41°C (p = 0.08), ואילו בניסוי בתומס ג'פרסון מצאו שחציון שליטה מקומית הוא 12 חודשים עם Tmin ≤ 39.5°C, לעומת 23 חודשים עבור Tmin >39.5°C (p=0.01).
הפגיעה התרמית לא הייתה שונה סטטיסטית בקרב חולים שטופלו בהיפרתרמיה פעם בשבוע לעומת פעמיים בשבוע. בניתוח של סטנפורד, רק כ-3/58 מהסיבוכים של חולים נזקקו לטיפול רפואי, וכ-2/58 נזקקו להתערבות כירורגית. קרוב ל-40% מהחולים בתומס ג'פרסון דווחו כי לא סבלו מתגובות עור הקשורות לטיפול; 11/56 מהאזורים המחוממים פיתחו שלפוחיות תרמיות, שהיו מאוזנות באותה מידה בין שתי הקבוצות.
הסיבה ששאלה זו הועלה עוסקת בתופעה של עמידות לחום (thermotolerance); כלומר, מרבית תאי היונקים הופכים עמידים בפני השפעות החום בטמפרטורות מתחת ל-43 מעלות צלזיוס, או ב37 מעלות צלזיוס לאחר חשיפה לטמפרטורות גבוהות מ-43 מעלות צלזיוס. ככל שמחקר נוסף נערך בתחום זה, נמצא שהעמידות לחום קשורה לחלבוני עקת חום (heat shock proteins HSPs) אשר מבוטאים בייצר בגלל היפרתרמיה. כתוצאה מכך, הרוב תומכים במרווח בין טיפולי ההיפרתרמיה של לפחות 48-72 שעות, על מנת לאפשר זמן מספיק להסרתם של החלבונים. למרות זאת, ישנם נתונים המצביעים על כך ההגברה הטרמית ברגישות הרקמה לקרינה (thermal radiosensitization) אינה נתונה לעמידות תרמית. Armour et al מצאו שהמעכב סינתזת חלבונים cycloheximide מונע הופעת עמידות תרמית, אך אינו משפיע על רגישות לקרינה. בהתחשב בממצא ביולוגי זה, תוכנית רב-מקטעי אגרסיבית יותר בהיפרתרמיה עשויה להיות מוצדקת, אך עד כה לא נוסה.
אוסף הנתונים הפרוספקטיביים הגדול ביותר לשילוב רדיותרפיה והיפרתרמיה לטיפול בסרטן שד שטחי, נערך במאמץ משותף על ידי המועצה למחקר רפואי בבריטניה, האגודה האירופית לאונקולוגיה היפרתרמית, קבוצת היפרתרמיה הולנדית ובית החולים הנסיכה מרגרט/מכון הסרטן באונטריו. נערכו בו-זמנית חמישה ניסויים פרוספקטיביים מתמשכים על ידי הקבוצות האמורות. בשל איסוף חולים לקוי, הוחלט לאגד את הנתונים שלהם כדי להגדיל את הכוח הסטטיסטי. כפי שניתן לצפות, על ידי שילוב של מספר ניסויים קיימת מידה רבה של הטרוגניות באוכלוסיות המטופלים, כמו גם בטיפול שניתן. במטא-אנליזה של האירופית והקנדית, היו שלוש קבוצות חולים ניתנות לזיהוי: סרטן שד ראשוני לא מטופל שאינו ניתן לניתוח, הישנות המחלה באזורים שלא הוקרנו לפני כן, ואלו עם הישנות המחלה באזורים שהוקרנו בעבר; 71% סבלו מהישנות בדופן בית החזה.
הקרנות בוצעו באופן רדיקלי (טווח מינון "יעיל" 60–69.3 Gy) אם כישלון הטיפול במטופל לא היה באזור שהוקרן בעבר, או פליאטיבי (טווח 39.8–47.2 Gy) אם זה כן היה. מטרתם בהיבט היפרתרמיה הייתה להשיג בתוך הגידול (intratumor) טמפרטורה מינימלית של 43 מעלות צלזיוס (ו-42.5 מעלות צלזיוס באחד מחמשת הניסויים). נקודת הסוף העיקרית שלהם הייתה השיעור של תגובה מלאה (CR), שהיה 59% ו-41% עם ובלי היפרתרמיה, בהתאמה (p <0.001, CI ,95% ,OR 2.3 1.4–3.8). בחולים שהוקרנו בעבר, שיעור התגובה המלאה היה 57% לעומת 31% (OR 4.7, 95% CI 2.4–9.5), שהיה במינוני קרינה 'פליאטיביים'. זה מייצג שיפור משמעותי בתגובה מלאה עם הוספה של היפרתרמיה לקרינה. בעוד ששיעור ההישרדות (overall survival) לא הייתה נקודת סוף ראשונית של אוסף ניסויים זה, היא הוערכה ע"י ניתוח קבוצות משנה. לא היה הבדל מובהק סטטיסטית בהישרדות בקרב חולים שהוקרנו עם או ללא היפרתרמיה, בעיקר בגלל שאחוז גבוה מהחולים בשתי הקבוצות שפיתחו מחלה גרורתית; שיעור הישרדות חציוני היה 18 חודשים, ללא קשר לאקראיות. עם זאת, בהתחשב בהיסטוריה הטבעית של הישנות סרטן השד, טיפול מקומי לא בהכרח צפוי לשפר את אחוז ההישרדות.
יש לציין כי מרבית החולים לא הגיעו לטמפרטורה מינימלית של 43 מעלות צלזיוס בתוך הגידול (intratumor) שהוגדרה בתחילת הניסויים. Sherar ואחרים, בדקו את כמות החשיפה התרמית (דוסימטר) של 120 חולים שהצטרפו, וביקשו למצוא פרמטרים מהמנים של טיפול שעשויים לנבא תגובה לטיפול. חמש נקודות סוף תרמיות נבחנו, מתוכן 2 נמצאו בקורלציה עם שיעור התגובה המלאה. המקסימום (TDmin), והסכום (TDmin), כש-TDmin היא הטמפרטורה הנמוכה ביותר שנרשמה במהלך הטיפול. הם הדגישו כי קשה להסיק מחולים ללא מחלת גרורות מרוחקות בכניסה, מכיוון שרק אחד מחמשת הניסויים בדקו האם יש מחלת גרורת מרחוקות לפני הכניסה לניסוי והיה עם תוצאות טובות יותר, כולל עלייה בשיעור תגובה מלאה, הישרדות מקומית ללא מחלה, זמן לכישלון מקומי ושיעור ההישרדות, עם שיפור באיכות ההיפרתרמיה (עם הפסקות של 10 דקות, או פחות/יותר מ-10 דקות).
בנוגע לרעילות בשילוב היפרתרמיה עם קרינה, הכותבים ציינו כי מספר קטן של המטופלים לא השלימו את הטיפול המתוכנן בהיפרתמיה משנית לכאב; הם לא ציינו בדיוק כמה. הם מצאו הבדל קטן בשיעורי האריתמה וקילוף העור בהוספת היפרתרמיה לקרינה, אבל דיווח על שיעור של 11% של שלפוחיות תרמיות בקבוצה המשולבת, לעומת שיעור של 2% בחולים שעברו קרינה בלבד. הם ציינו כי רעילות אקוטית הקשורה לטיפול חלפה עם אמצעים שמרניים בלבד. זוהו שלושה סיבוכים מאוחרים הקשורים לטיפול המשולב (נמק בעצם, שבר בעצם ופלקסופתיה ברכיאלית), המדגישים את החשיבות בביצוע מעקב ארוך טווח במצבם של החולים ששרדו.
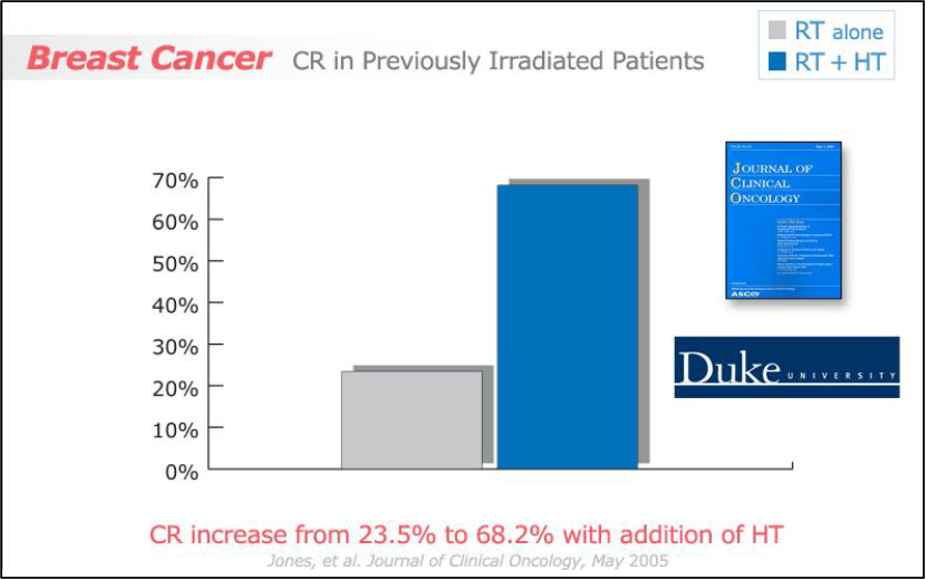
הניסוי הקליני העדכני ביותר שדווח לאחרונה בשלב III על הקרנות עם או ללא היפרתרמיה היה מאוניברסיטת דיוק. מחקר זה היה קפדני בהתאמת התנאים של התרמומטרים/ מינון תרמי בהתאם להנחיות וכללו בדיקת מינון של היפרתרמיה לפני ביצוע רנדומיזציה כדי להבטיח שכל החולים אכן היו עם יכולת לעבור חימום. מתוך 122 החולים שגויסו, 108 חולים הוערכו ככאלו שיכולים לעבור חימום ועברו רנדומיזציה. מבין אותם חולים, 65% חלו במחלה בשד או בדופן בית החזה. בסך הכל, שיעור התגובה המלאה היה 66.1% בקרב חולים שטופלו הן בהיפרתרמיה והן ברדיותרפיה, לעומת 42.3% בקבוצת הזרוע שטופלה ברדיותרפיה בלבד (p = 0.02, OR 2.7, 95% CI 1.2–5.8). הפרמטר התרמי בו נעשה שימוש היה מספר סך כל הדקות המצטברות ב-43 מעלות צלזיוס העולות על 90% מהנקודות המפוקחות בתוך הגידול (CEM 43°C T90), הדומה לאחת משתי נקודות הסוף שהוערכו על ידי Sherar ונוספים. נמצאו בעל השפעה משמעותית על תגובה מלאה (sum (TDmin) שזהו CEM 43 °C T100) ג'ונס ונוספים, מצאו כי ה- CEM 43°C T90 היה גורם ניבוי חזק עבור תגובה מלאה, כפי שנמצא ע"י מועצת המחקר הרפואי באנליזה של הנתונים שלהם. כמו במטא-אנליזה של ורנון, החולים שהפיקו את התועלת הגדולה ביותר היו אלו שקיבלו בעבר טיפול בהקרנות, עם שיעורי תגובה מלאה של 68.2% עם היפרתרמיה ו-23.5% ללא היפרתרמיה. באופן לא מפתיע, לא היו הבדלים בשיעורי ההישרדות בין שתי הקבוצות.
מסקנות
אמנם יש כמה הבדלים בערך על היפרתרמיה שטחית וקרינה, נראה שיש נושא אחד המאחד אותם. בקבוצה נבחרת של חולים, הוספת היפרתרמיה לרדיותרפיה מעצימה את חיסול הגידול המקומי, עם עלייה צנועה ברעילות מוגבלת במידה רבה. בעוד שהשגת תגובת מלאה היא נקודת סוף ראויה למחקר, יש לקחת בחשבון גם את הצורך להתייחס להקלת הסימפטומים, בכך שרוב החולים ייכנעו בסופו של דבר למחלתם המפושטת. בעידן המודרני של טיפול 'ממוקד', נושא השליטה המקומית הופך ליותר ויותר חשוב. יישום עתידי של היפרתרמיה בשילוב עם הקרנות צריך לכלול הוספת חומרים ביולוגיים ממוקדים מתוך תקווה להגדיל את קצב התגובה המלאה ובתקווה לתרגם להישרדות ממושכת ללא מחלה.
דוקסורוביצין ליפוזומאלי שולב עם רדיותרפיה והיפרתרמיה על ידי קבוצה אחת ומצדיק הערכה נוספת בעתיד. יש לנקוט מאמצים כדי לספק חימום יעיל של גידולים כך שההשפעה הסינרגטית של שילוב הקרנות והיפרתרמיה יכול להיות אופטימלי. עם דוסימטריה תרמית קפדנית וטכניקת טיפול זהירה, הוספת חום לרדיותרפיה יכול להוביל לשליטה מקומית לטווח-ארוך בהישנות סרטן השד וסרטן קיר בית החזה.



