
Combined hyperthermia and radiotherapy for prostate cancer: a systematic review
International Journal of hyperthermia, Mar 2022, VOL. 39:1, 547-556
Jennifer Le Guevelou, Monica Emilia Chirila, Vérane Achard, Pauline Coralie Guillemin, Orane Lorton, Johannes W. E. Uiterwijk, Giovanna Dipasquale, Rares Salomir & Thomas Zilli
תקציר
מיטוב אסטרטגיות הטיפול בחולי סרטן הערמונית המטופלים בהקרנות כחלק מטיפול קורטיבי מרפא (RT) מייצג את אחד האתגרים הגדולים עבור האונקולוג המקרין. העלאת מינון או שילוב הקרנות עם טיפולים סיסטמיים משמשים לשיפור השליטה בגידול בחולים עם סרטן ערמונית בדרגת סיכון גבוהה (unfavourable prostate cancer), בסיכון לעלייה בשיעור וחומרה של רעילות הקשורה לטיפול. הוכח כי העלאת הטמפרטורה לרמה על-פיזיולוגית מגבירה את חמצון הגידול ומפחיתה את יכולות תיקון הדנ"א. לפיכך, היפרתרמיה (HT) בשילוב עם הקרנות מייצגת אסטרטגיית טיפול משכנעת לשיפור המדד התרפויטי בחולי סרטן הערמונית. מטרת הסקירה השיטתית הנוכחית היא לדווח על ראיות פרה-קליניות וקליניות התומכות בשילוב של היפרתרמיה והקרנות לסרטן הערמונית, תוך דיון ביישומים ובפיתוחים עתידיים של טיפול משולב זה.
מבוא
טיפול בקרינה מייצג את אחד הטיפולים הסטנדרטיים לסרטן הערמונית. למרות הכוונה המרפאת, שיעור משתנה מהחולים שטופלו בהקרנות יפתחו עם הזמן הישנות מקומית (local relapse LR), המוגדרת כעלייה באנטיגן ספציפי לערמונית (PSAprostate-specific antigen ) בשילוב עם ביופסיה חיובית של הערמונית ו/או טומוגרפיית פליטת פוזיטרונים (PET) חיובית. בהגדרה הסופית, שיעור זה נע בין 3 ל-10%, האחוזים הגבוהים ביותר נמצאים באוכלוסיית המחלה בסיכון גבוה. עד כה, מספר ניסויים אקראיים הראו שיפור בשליטה המקומית והביוכימית עם העלאת המינון (dose-escalation), עם מינון של 76-78 Gy המומלץ כמינון סטנדרטי שגרתי במקטעים. ובכל זאת, אם פרוטוקולי 78 Gy יכלו להשיג שיעור של 95.6% ו-99.5% בשליטה המקומית והביוכימית במשך 15 שנה באוכלוסיית המחלה בסיכון נמוך, שיעורים אלה ירדו, בהתאמה, ל-91.3% ו-88.7% בחולים עם מחלה בסיכון גבוה. באופן דומה, במסגרת שלאחר הניתוח, התפתחות הישנות מקומית במיטת הערמונית משקפת סיטואציה מאתגרת בעבור טיפול בהקרנות הצלה, המאופיין בשונות גבוהה בפרדיגמות הטיפול ובתוצאה כללית גרועה. התעצמות הטיפול עם עלייה במינון ההקרנות או הוספה של חומרים סיסטמיים, כגון טיפול להפחתת אנדרוגן (-androgen deprivation therapyADT) נבחנה הן במסגרות הדפיניטיביות והן במסגרות ההצלה כדי למטב את התוצאות של חולים עם מאפייני סיכון גבוה. עם זאת, למרות השיפורים בטכניקות ההקרנה כולל שימוש שגרתי בקרינה מייננת בעלת עוצמה מאופננת (Intensity-modulated radiation therapy–IMRT) וטיפול בהקרנות מונחה-תמונה (Image-guided radiation therapy –IGRT), שיפור בשליטת הגידול קשור לעתים קרובות להגברת תופעות הלוואי לטווח ארוך, מה שמבליט את הצורך למצוא אסטרטגיות לשיפור היחס התרפויטי.
השילוב של היפרתרמיה והקרנות מייצג אסטרטגיית טיפול מפתה, לשיפור השליטה המקומית בגידול מבלי להגביר את הסיכון לרעילות ברקמות הבריאות שמסביב. בעוד שמספר מחקרים מצביעים על השפעה סינרגטית בין הקרנות להיפרתרמיה, Kok ואח’. העריכו כי הוספה של היפרתרמיה מספקת מינון שווה ערך ל-10 Gy גבוה יותר מאשר הקרנות בלבד. מנקודת מבט קלינית, הוספה של היפרתרמיה הוכחה כמשפרת את השליטה המקומית במיקומי גידול רבים. דווח יתרון של 10-20% בשיעורי השליטה המקומית לסרטן צוואר הרחם, רקטום ושלפוחית השתן, המתורגם גם לתועלת הישרדותית משמעותית לסרטן צוואר הרחם (הישרדות כוללת ל3 שנים, של 51% לעומת 27% עם או בלי הוספת היפרתרמיה, בהתאמה, p = 0.009). ההתקדמות הטכנית האחרונה במערכות היפרתרמיה הופכת את השילוב של היפרתרמיה והקרנות לאסטרטגיה חדשנית לשיפור שליטה בגידול ומניעת רעילות ארוכת טווח בטיפול הקורטיבי בסרטן הערמונית. מטרת הסקירה השיטתית הנוכחית היא לדווח על ראיות התומכות בשילוב של היפרתרמיה והקרנות לסרטן הערמונית, כולל יישומים עתידיים ופיתוח אסטרטגיית טיפול חדשה זו.
חומרים ושיטות
מחקרים שפורסמו מדווחים על שיעורים נמוכים יחסית של רעילות הקשורה לטיפול בעת שילוב היפרתרמיה ו-EBRT. שיעורי רעילות חריפים בדרגה 2 של מערכת המין והשתן (Genito-urinary) נעו בין 0% ל-55%, בעוד שרעילות חריפה של מערכת המין והשתן בדרגה 3 דווחה בשלושה מחקרים בלבד. במסגרת הראשונית, שיעור זה נותר אנקדוטי, ונע בין 1% ל -4%. במקרה של הקרנה חוזרת, שכיחות זו הגיעה לשיעור של 18%. ברעילות חריפה בדרגה 2 דווחה בשכיחות גבוהה יותר, במערכת העיכול (GI) והגיעה לשיעור של 48% במחקר שנערך על ידי Anscher ואח’., המורכבת בעיקר משלשולים. השפעות חריפות במערכת העיכול בדרגה 3 נצפו רק בחולים שעברו הקרנה חוזרת עבור הישנות מקומית, עם שיעור רעילות של 14% שדווח במחקר על ידי Van Vulpen ואח’. במחקר של Yahara ואח’. לא נצפה הבדל בהיארעות של רעילות חריפה של מערכת המין והשתן או במערכת העיכול בדרגה ≥2 בין חולים שטופלו עם או ללא טיפולי היפרתרמיה אזורית. מכיוון שהחשש הוא מרעילות לטווח ארוך, לא דווח על רעילות מאוחרת בדרגה ≥3. רק שני מקרים של רעילות מאוחרת בדרגה 4 נצפו בשני חולים במסגרת טיפולי ההצלה (דלקת שלפוחית השתן הדימומית בחולה עם מחסור בפקטור XI וכימותרפיה ללימפומה, ופיסטולה רקטו-וזיקלית לאחר היעלמות של גידול גדול ונמקי, בחולה אחר). רעילות היפרתרמיה ספציפית, הכוללת כוויות בעור או כאבים, דווחה באופן לא עקבי במחקרים שונים. Tilly ואח’. דיווחו על שיעורים של 68% ו-9% של רעילות עור חריפה בדרגה 1 ו-2, בהתאמה. Yahara ואח’. דיווחו על תוצאות דומות, כאשר כוויה בעור בדרגה 2 אירעה בקרב 6% מהמטופלים. הסימפטומים המוצגים כמו התקשות תת עורית, נפתרו באופן ספונטני לאחר השלמת ההיפרתרמיה. במסגרת המחקר בראשות Kalapurakal ואח’., אף מטופל לא פיתח כוויות עור הנגרמו על ידי היפרתרמיה.
Kukielka ואח’. דיווחו על תוצאות רעילות לאחר שילוב של היפרתרמיה אינטרסטיציאלית וברכיתרפיה. באוכלוסיית מחקר הטרוגנית, הכותבים כללו חולים שטופלו בהיפרתרמיה וברכיתרפיה בלעדי (45 Gy בשלושה מקטעים לחולים בסיכון נמוך) או EBRT עם בוסטים של ברכיתרפיה (50 Gy + 21 Gy ב3 מקטעים). חולים אחרים עם הישנות לאחר הקרנות, טופלו ב-30 Gy בשלושה מקטעים והיפרתרמיה. פרופילים קודמים של רעילות הראו את הבטיחות של הגישה המשולבת עם היפרתרמיה שבוצעה לפני ברכיתרפיה, עם פרופיל רעילות הדומה לחולים שטופלו בברכיתרפיה בלבד. הרעילות השכיחה ביותר של מערכת המין והשתן כללה תדירות במתן שתן (27%) ודווחה בעיקר בחולים שטופלו בברכיתרפיה והיפרתרמיה במסגרת הדפיניטיבית הראשונית (67%). לא נצפתה רעילות שתן בדרגה 3, אפילו באוכלוסיית המטופלים המוקרנים מחדש לאחר קורס EBRT קודם. בנוסף, לא נצפו סיבוכים רקטליים מוקדמים.
התפקיד של היפרתרמיה בשילוב עם EBRT הוערך גם בניסוי היפרתרמיה-ערמונית (NCT0415905) עבור חולים בהישנות ביוכימית לאחר כריתה רדיקלית של הערמונית. במחקר זה, 7-10 טיפולים של היפרתרמיה בוצעו בשילוב עם הקרנות במינון של 70 Gy למיטת הערמונית. אנליזת הביניים שבוצעה בניסוי זה דיווחה על שיעורי רעילות אקוטית נמוכים יחסית, עם שיעור של 10% ו-4% רעילות אקוטית של מערכת המין והשתן ומערכת העיכול בדרגה 2, בהתאמה. 42% מהמטופלים חוו רעילות אקוטית בדרגה 1 ספציפית להיפרתרמיה, אשר כללה בעיקר דלקת עור רטובה (Hot Spot) וכאבי עור.
נתונים פרה-קליניים
הן ניסויים במבחנה (in vitro) והן בבעלי חיים מדגישים את ההשפעה הסינרגטית של היפרתרמיה והקרנות על השמדת תאי גידול בסרטן הערמונית.
אחד מניסויי המבחנה (in vitro) הראשונים בוצע על תרביות תאי סרטן הערמונית DU145 כספרואידים. שיעור גבוה יותר של נזק לדנ"א דווח לאחר חשיפת התאים לטיפול היפרתרמיה של 43 מעלות צלזיוס למשך 90 דקות, שבוצע עם מערכת קיבולית בגלי-רדיו (radiofrequency capacitive system), ולאחריו טיפול בקרינה חיצונית של 4 Gy (external beam radiation therapy – EBRT), בניגוד לטיפולי היפרתרמיה או EBRT בלבד. כתוצאה מכך, אחוז גבוה יותר של תאים אפופטוטיים נצפה בקרב התאים שטופלו בשילוב היפרתרמיה והקרנות (64.48 ± 3.40% לעומת 27.70 ± 3.5% ללא היפרתרמיה), מה שמדגיש את היכולת של היפרתרמיה להגביר את הרגישות להקרנות. בנוסף, באותם קווי תאים, סקירת נזק לדנ"א הראה כי שילוב של EBRT (4 Gy) והיפרתרמיה נמצא יעיל באותה המידה כמו תוכנית עם מינון גדל (dose-escalated schedule) שמשלב 2 Gy שניתן על ידי EBRT עם תוספת (boost ) של ברכיתרפיה (BT) 2.24 Gy. אפילו באוכלוסיות תאים עמידים לקרינה, כגון תאי הגזע של סרטן הערמונית, השילוב של היפרתרמיה והקרנות הוכיח את יכולתו להפחית את שבר הישרדות המושבה (colony survival fractions) בהשוואה להקרנות בלבד (עד פקטור של 100), מה שמצביע על כך שהטיפול המשולב עשוי להיות גישה מבטיחה להגברת האפקט הציטוטוקסי הנגרם על ידי קרינה. עם זאת, יש להתייחס בזהירות למודלים פרה-קליניים אלה, שכן לכל סוג תא יש רגישות ייחודית להיפרתרמיה (לדוגמה, תאי Dunning R3327 עמידים במיוחד לחום), ולכל מודל תרבית תאים המגבלות שלו (למשל, תרביות ספרואידים כנראה מתאימות יותר מתרביות חד-שכבתיות).
ההשפעה המשולבת של הקרנות והיפרתרמיה נחקרה גם כן במודלים של עכברים עירומים אתימיים שהושתלו בשתל קרצינומה של הערמונית. Kaver ואח’. סיפקו ראיות לכך שהטיפול המשולב היה היעיל ביותר בהאטת צמיחת הגידול. הזמן החציוני של הכפלת נפח הגידול היה 35.5 ימים בשילוב היפרתרמיה והקרנות, לעומת 18 ו-25.5 ימים עבור היפרתרמיה או הקרנות בלבד, בהתאמה, מה שאישר לכל הפחות את אפקט ההוספה. במחקר אחר, כהן ואח'. שילבו היפרתרמיה עם מנה אחת של 12 Gy, בעכברים שהושתלו בתאים אנושיים של סרטן הערמונית. היפרתרמיה ניתנה באמצעות מכשיר גלי-רדיו – Oncotherm LAB EHY-100. התוצאות היו עקביות עם ניסויים קודמים, עם השפעה החיבורית של היפרתרמיה וטיפולי הקרנות (33.4 ימים זמן ההכפלה בטיפולים שהיו משולבים, לעומת 30.4 ו-4.5 ימים עם הקרנות והיפרתרמיה בלבד, בהתאמה). באוכלוסיית חולדות שהושתלו עם קרצינומה אנאפלסטית של הערמונית, טיפולים משולבים גם כן הדגימו יחס תרפויטי משופר, עם עיכוב משמעותי בצמיחת הגידול כאשר מספר טיפולי היפרתרמיה ניתנו לפני ברכיתרפיה (44 ימים בעיכוב צמיחת הגידול כאשר טיפול היפרתרמיה יחיד בוצע לפני הקרנות לעומת 53.7 ימים שבהם היפרתרמיה בוצעה הן לפני ברכיתרפיה והן אחרי).
להלן איור 1: PRISMA flow chart.
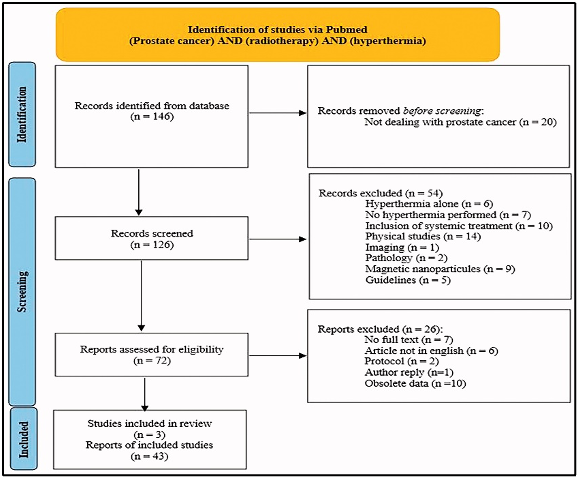
נתונים קליניים
הן ניסויים במבחנה (in vitro) והן בבעלי חיים מדגישים את ההשפעה הסינרגטית של היפרתרמיה והקרנות על השמדת תאי גידול בסרטן הערמונית.
אחד מניסויי המבחנה (in vitro) הראשונים בוצע על תרביות תאי סרטן הערמונית DU145 כספרואידים. שיעור גבוה יותר של נזק לדנ"א דווח לאחר חשיפת התאים לטיפול היפרתרמיה של 43 מעלות צלזיוס למשך 90 דקות, שבוצע עם מערכת קיבולית בגלי-רדיו (radiofrequency capacitive system), ולאחריו טיפול בקרינה חיצונית של 4 Gy (external beam radiation therapy – EBRT), בניגוד לטיפולי היפרתרמיה או EBRT בלבד. כתוצאה מכך, אחוז גבוה יותר של תאים אפופטוטיים נצפה בקרב התאים שטופלו בשילוב היפרתרמיה והקרנות (64.48 ± 3.40% לעומת 27.70 ± 3.5% ללא היפרתרמיה), מה שמדגיש את היכולת של היפרתרמיה להגביר את הרגישות להקרנות. בנוסף, באותם קווי תאים, סקירת נזק לדנ"א הראה כי שילוב של EBRT (4 Gy) והיפרתרמיה נמצא יעיל באותה המידה כמו תוכנית עם מינון גדל (dose-escalated schedule) שמשלב 2 Gy שניתן על ידי EBRT עם תוספת (boost ) של ברכיתרפיה (BT) 2.24 Gy. אפילו באוכלוסיות תאים עמידים לקרינה, כגון תאי הגזע של סרטן הערמונית, השילוב של היפרתרמיה והקרנות הוכיח את יכולתו להפחית את שבר הישרדות המושבה (colony survival fractions) בהשוואה להקרנות בלבד (עד פקטור של 100), מה שמצביע על כך שהטיפול המשולב עשוי להיות גישה מבטיחה להגברת האפקט הציטוטוקסי הנגרם על ידי קרינה. עם זאת, יש להתייחס בזהירות למודלים פרה-קליניים אלה, שכן לכל סוג תא יש רגישות ייחודית להיפרתרמיה (לדוגמה, תאי Dunning R3327 עמידים במיוחד לחום), ולכל מודל תרבית תאים המגבלות שלו (למשל, תרביות ספרואידים כנראה מתאימות יותר מתרביות חד-שכבתיות).
ההשפעה המשולבת של הקרנות והיפרתרמיה נחקרה גם כן במודלים של עכברים עירומים אתימיים שהושתלו בשתל קרצינומה של הערמונית. Kaver ואח’. סיפקו ראיות לכך שהטיפול המשולב היה היעיל ביותר בהאטת צמיחת הגידול. הזמן החציוני של הכפלת נפח הגידול היה 35.5 ימים בשילוב היפרתרמיה והקרנות, לעומת 18 ו-25.5 ימים עבור היפרתרמיה או הקרנות בלבד, בהתאמה, מה שאישר לכל הפחות את אפקט ההוספה. במחקר אחר, כהן ואח'. שילבו היפרתרמיה עם מנה אחת של 12 Gy, בעכברים שהושתלו בתאים אנושיים של סרטן הערמונית. היפרתרמיה ניתנה באמצעות מכשיר גלי-רדיו – Oncotherm LAB EHY-100. התוצאות היו עקביות עם ניסויים קודמים, עם השפעה החיבורית של היפרתרמיה וטיפולי הקרנות (33.4 ימים זמן ההכפלה בטיפולים שהיו משולבים, לעומת 30.4 ו-4.5 ימים עם הקרנות והיפרתרמיה בלבד, בהתאמה). באוכלוסיית חולדות שהושתלו עם קרצינומה אנאפלסטית של הערמונית, טיפולים משולבים גם כן הדגימו יחס תרפויטי משופר, עם עיכוב משמעותי בצמיחת הגידול כאשר מספר טיפולי היפרתרמיה ניתנו לפני ברכיתרפיה (44 ימים בעיכוב צמיחת הגידול כאשר טיפול היפרתרמיה יחיד בוצע לפני הקרנות לעומת 53.7 ימים שבהם היפרתרמיה בוצעה הן לפני ברכיתרפיה והן אחרי).
רעילות
הן ניסויים במבחנה (in vitro) והן בבעלי חיים מדגישים את ההשפעה הסינרגטית של היפרתרמיה והקרנות על השמדת תאי גידול בסרטן הערמונית.
אחד מניסויי המבחנה (in vitro) הראשונים בוצע על תרביות תאי סרטן הערמונית DU145 כספרואידים. שיעור גבוה יותר של נזק לדנ"א דווח לאחר חשיפת התאים לטיפול היפרתרמיה של 43 מעלות צלזיוס למשך 90 דקות, שבוצע עם מערכת קיבולית בגלי-רדיו (radiofrequency capacitive system), ולאחריו טיפול בקרינה חיצונית של 4 Gy (external beam radiation therapy – EBRT), בניגוד לטיפולי היפרתרמיה או EBRT בלבד. כתוצאה מכך, אחוז גבוה יותר של תאים אפופטוטיים נצפה בקרב התאים שטופלו בשילוב היפרתרמיה והקרנות (64.48 ± 3.40% לעומת 27.70 ± 3.5% ללא היפרתרמיה), מה שמדגיש את היכולת של היפרתרמיה להגביר את הרגישות להקרנות. בנוסף, באותם קווי תאים, סקירת נזק לדנ"א הראה כי שילוב של EBRT (4 Gy) והיפרתרמיה נמצא יעיל באותה המידה כמו תוכנית עם מינון גדל (dose-escalated schedule) שמשלב 2 Gy שניתן על ידי EBRT עם תוספת (boost ) של ברכיתרפיה (BT) 2.24 Gy. אפילו באוכלוסיות תאים עמידים לקרינה, כגון תאי הגזע של סרטן הערמונית, השילוב של היפרתרמיה והקרנות הוכיח את יכולתו להפחית את שבר הישרדות המושבה (colony survival fractions) בהשוואה להקרנות בלבד (עד פקטור של 100), מה שמצביע על כך שהטיפול המשולב עשוי להיות גישה מבטיחה להגברת האפקט הציטוטוקסי הנגרם על ידי קרינה. עם זאת, יש להתייחס בזהירות למודלים פרה-קליניים אלה, שכן לכל סוג תא יש רגישות ייחודית להיפרתרמיה (לדוגמה, תאי Dunning R3327 עמידים במיוחד לחום), ולכל מודל תרבית תאים המגבלות שלו (למשל, תרביות ספרואידים כנראה מתאימות יותר מתרביות חד-שכבתיות).
ההשפעה המשולבת של הקרנות והיפרתרמיה נחקרה גם כן במודלים של עכברים עירומים אתימיים שהושתלו בשתל קרצינומה של הערמונית. Kaver ואח’. סיפקו ראיות לכך שהטיפול המשולב היה היעיל ביותר בהאטת צמיחת הגידול. הזמן החציוני של הכפלת נפח הגידול היה 35.5 ימים בשילוב היפרתרמיה והקרנות, לעומת 18 ו-25.5 ימים עבור היפרתרמיה או הקרנות בלבד, בהתאמה, מה שאישר לכל הפחות את אפקט ההוספה. במחקר אחר, כהן ואח'. שילבו היפרתרמיה עם מנה אחת של 12 Gy, בעכברים שהושתלו בתאים אנושיים של סרטן הערמונית. היפרתרמיה ניתנה באמצעות מכשיר גלי-רדיו – Oncotherm LAB EHY-100. התוצאות היו עקביות עם ניסויים קודמים, עם השפעה החיבורית של היפרתרמיה וטיפולי הקרנות (33.4 ימים זמן ההכפלה בטיפולים שהיו משולבים, לעומת 30.4 ו-4.5 ימים עם הקרנות והיפרתרמיה בלבד, בהתאמה). באוכלוסיית חולדות שהושתלו עם קרצינומה אנאפלסטית של הערמונית, טיפולים משולבים גם כן הדגימו יחס תרפויטי משופר, עם עיכוב משמעותי בצמיחת הגידול כאשר מספר טיפולי היפרתרמיה ניתנו לפני ברכיתרפיה (44 ימים בעיכוב צמיחת הגידול כאשר טיפול היפרתרמיה יחיד בוצע לפני הקרנות לעומת 53.7 ימים שבהם היפרתרמיה בוצעה הן לפני ברכיתרפיה והן אחרי).
פרמטרים תרמיים ואתגרים טכניים
במסגרת סקירה זו, רוב הטיפולים בוצעו באמצעות חימום אלקטרומגנטי, באמצעות שימוש במכשירי גלי-רדיו. בעוד שרוב המחקרים העדיפו היפרתרמיה אזורית (קרינתית עם APA, או קיבולית), כמה מחקרים העדיפו גישה מקומית באמצעות היפרתרמיה אינטרסטיציאלית (בדרך כלל בשילוב עם טכניקת ברכיתרפיה אינטרסטיציאלית) או טכניקות אולטרסאונד טרנס-רקטלי/טרנס-אורטרלית. מכשירי APA, המבוססים על ממיקום מספר אנטנות סביב המטופל, היו בשימוש נרחב לטיפולי היפרתרמיה עמוקים בגידולי אגן. גישה זו מביאה את היתרונות הגדולים של גישה הנותרת לא פולשנית תוך מתן חימום מדויק של הגידול והימנעות מדלקות עור של רקמות תקינות. היפרתרמיה קיבולית היא גישה אזורית נוספת דרך גלי-רדיו. ובכל זאת, היא בעלת החיסרון המתבטא בעדיפות החימום של רקמות שומן תת עוריות, ולכן נחשבת פחות מתאימה לחולי סרטן הערמונית לבני-עור (Caucasian). יישום חימום באולטרסאונד לחולי סרטן הערמונית יכול להיחשב מאתגר בשל סיכוני שדה קרוב ורחוק של הצטברות תרמית. נדרשת התאמה מחושבת של פרמטרים אקוסטיים. באופן אופטימאלי, ניטור טמפרטורה רב-מישורי או תלת-ממדי צריך להיות זמין באופן מקוון. רק שלושה מחקרים דיווחו על תוצאות חימום על ידי אולטרסאונד, בגישה טרנס-רקטלית. מחקר הרצה קליני נוסף, דיווח על היפרתרמיה עם ניטור מבוקר בתלת-ממד על-ידי מולכי אולטרסאונד מבוססי צנתר בשילוב עם ברכיתרפיה בקצב מינון גבוה (HDR high-dose-rate – ).
כמה ניסויים הדגימו את הקורלציה בין פרמטרים תרמיים לתוצאות קליניות. bRFS גבוה יותר נמצא בקרב מטופלים שקיבלו היפרתרמיה מעל 43 מעלות צלזיוס למשך דקה אחת, עם יחס סיכויים (odds ratio) של 4.4 (1.15-16.67, 0.03).Tilly ואח', הציעו בנוסף כי Tmax היה מנבא של בקרת PSA, עם חתך של 41.2 מעלות צלזיוס, בעוד Emami ואח’. העריכו יעד טמפרטורה של 41.5 מעלות צלזיוס כמשביע רצון. פרמטרים תרמיים גבוהים יותר נמצאו קשורים גם לשיפור ב-bRFS במחקר בראשות Yahara ואח’. עם זאת, המינונים התרמיים האופטימליים לקרצינומה של הערמונית הנדרשים לטיפול משולב יעיל אינם ידועים בדיוק.
Kok ואח’. העריכו כי תוספת של היפרתרמיה הניתנת פעם או פעמיים בשבוע מספקת מינון שווה ערך של 10 Gy גבוה יותר מאשר הקרנות בלבד. במחקר הנוכחי החוקרים דיווח על מחקרים שהשתמשו בתזמוני הקרנות-היפרתרמיה שונים, כאשר היפרתרמיה בוצעה לפני, במהלך או אחרי ההקרנות. כאשר הרציונל לביצוע היפרתרמיה לפני הקרנות כלל הגברת החמצון לגידול על-ידי התרחבות כלי הדם, השפעות פרדוקסליות עם היפוקסיה מוגברת דווחו גם בטמפרטורות גבוהות יותר, עקב נזק לכלי הדם. בנוסף, מחקרים מסוימים שנעשו במודלים של בעלי חיים הדגימו הגברת רעילות הרקמה הרגילה כשהיפרתרמיה בוצעה לפני ההקרנות. מכיוון שהתוצאות הטובות ביותר במונחים של רגישות לקרינה נמצאו עם היפרתרמיה והקרנות בו זמנית, ניתן היה להעדיף רצף זה, ועדיין היישום הטכני נותר מאתגר. נכון לכתיבת המאמר, לא הושגה הסכמה על שילוב היפרתרמיה והקרנות, תכנון וניטור קפדניים של החימום מומלץ בכל רצף השימוש.
קיימים אתגרים טכניים בכל הנוגע למתן הטיפול, שכן קיים קושי להשיג את יעדי הטמפרטורה בבלוטת הערמונית. בגישת גלי-רדיו באמצעות מכשיר APA, תוצאות מאכזבות פורסמו על ידי Anscher ואח’., כאשר יעדי טמפרטורה הושגו רק ב-3.6% מהחולים. למרות הנטייה המוגברת לטיפולים מקומיים והפוטנציאל להשיג טמפרטורות גבוהות יותר בתוך בלוטת הערמונית, אפילו בגישת אולטרה-סאונד טרנס-רקטלי (TRUS), רק 36% מהמטופלים הגיעו ליעד הטמפרטורה של 42.5 מעלות צלזיוס במחקר בראשות Fosmire ואח’. ההתפתחויות האחרונות באולטרסאונד ההיפרתרמיה, כגון אולטרסאונד ממוקד מונחה תהודה מגנטית (MR) טומנות בחובן פוטנציאל לשפר את היחס התרפויטי, על ידי אספקת איזותרמים אחידים בתוך המטרה, המתירים בו זמנית אפשרות גדולה יותר לחוס על רקמות בריאות מסביב.
לבסוף, יכולת ההשוואה בין מחקרים של טמפרטורות ערמונית המושרות על ידי היפרתרמיה מוגבלת על ידי מספר גורמים. פער גדול קיים בניטור הטמפרטורה בין המחקרים, שיכולים להתבצע עם בדיקות שופכה, רקטליות או שלפוחית השתן. בנוסף, הערכה של פרמטרים תרמיים בהיפרתרמיה של הערמונית נותר לקוי בעקבות חוסר מידע על כלי הדם ועל הפרפוזיה, אשר יכול להוביל הערכת יתר של טמפרטורת הערמונית של 1-2 מעלות. מכיוון שתרמומטריה פולשנית נותרה הטכניקה הקלינית המקובלת, תרמומטריה מבוססת MR טומנת בחובה את הפוטנציאל לשפר את תוצאות הטיפול, על ידי מתן התפלגות טמפרטורה תלת-ממדית מלאה הנרשמת יחד עם הדמיה אנטומית. ובכל זאת, לתרמומטריה של תדר תהודת פרוטונים (PRFSproton resonance frequency shift- ) MR יש את החיסרון העיקרי בהיותם בעלי רגישות מוגברת לתנועת רקמות, אשר יכול להיות מגביל עבור איברים, כגון בלוטת הערמונית. ואכן, היא נוטה לתנועה לא מחזורית שמקורה בדופן רקטלית הסמוכה, בשל נוכחותם של כיסי גז נעים, מילוי הדרגתי של שלפוחית השתן או שיעול. עניין זה נחקר בהרחבה בתחום הקרנות הערמונית (התנועה הפנימית של הערמונית מוערכת בכ-3 מ"מ הן בציר אינפריור-סופריור והן בציר אנטריור-פוסטריור), עדיין חסרים נתונים לטיפולי היפרתרמיה ארוכים יותר. דיוק טוב של תרמומטריה MR הושג בהיפרתרמיה של הערמונית באמצעות מערכת TUSLA מבית Deep Medical (מיסיסוגה, קנדה), במשך טיפולים של 11-52 דקות. למרות שתרמומטריה MR בוצעה כדי לפקח על טמפרטורות אבולוטיביות (מעל 57 מעלות צלזיוס), היא אפשרה לקבל רדיוס טמפרטורה סביב הערמונית עד 37 מעלות צלזיוס, כחלק מאסטרטגיית הבטיחות. עד כה, המערכת יושמה ב224 חולים. עם זאת, המערכת אוחזת בחיסרון של היותה פולשנית, כפי שהיא כוללת מוליך אולטרסאונד נוקשה לשופכה כדי לייצב את בלוטת הערמונית. בסך הכל, באמצעות פרמטרים מתאימים לרכישת נתוני PRFS MR וסינון לאחר עיבוד, הושג דיוק כללי של תרמומטריה קרוב ל-1 מעלות צלזיוס. תרמומטרית MRI דינמית הוערכה על ידי צוותים שונים, עבור איברי הבטן, עם תוצאות משביעות רצון.
דיון
אסטרטגיות המסוגלות לשפר את היחס התרפויטי בחולי סרטן הערמונית עם מחלה מקומית מתקדמת או גידולים חוזרים המטופלים בהקרנות קורטיביות נדרשות בשקיקה.
אצל גברים עם סרטן ערמונית בסיכון גבוה או מקומי מתקדם, העלאת מינון המבוצע או על כל הערמונית באמצעות טכניקות EBRT ו/או ברכיתרפיה, או על-ידי בוסט מוקדי על הנגע הדומיננטי בתוך הערמונית, מייצגת את אחת האסטרטגיות הנחקרות ביותר המשמשות לשיפור השליטה בגידול. שיפורים בשיעורי ה-bRFS הודגמו עם העלאה במינון, אם כי לעתים קרובות יתרון זה ניצב מול עלייה בשיעורי הרעילות של מערכת המין והשתן ומערכת העיכול. במצב הספציפי של גידולים מקומיים מתקדמים, הקרנות דפיניטיביות בשילוב עם טיפול ארוך טווח בנוגדי אנדרוגנים, נותר אבן היסוד בטיפול, ומספק הישרדות ללא הישנות של 5 שנים של 74% בניסויים היסטוריים. הוספת ההיפרתרמיה לטיפול הקונבנציונאלי של הורמון והקרנות עשויה לייצג חלופה חשובה במסגרת זו. באוכלוסיית חולים שאובחנו בעיקר עם גידולים מקומיים מתקדמים (שיעור של 61% גידולי T3-T4), Yahara ואח’. דיווחו על שיפור השליטה במחלה הן ב- bRFS והן בהישרדות ספציפית לסרטן לאחר 5 שנים עם הוספה של היפרתרמיה. בהתבסס על התוצאות המבטיחות של מחקרים המוצגים בטבלה 1, ניסויים פרוספקטיביים הבוחנים את התפקיד של שילוב היפרתרמיה והקרנות לעומת הקרנות בלבד דרושים באוכלוסיית חולים זו.
טיפולים מקומיים לא כירורגים להצלה מציגים סיכוי לגישה מקומית מרפאת בהישנות של סרטן הערמונית לאחר טיפולי קרינה. הקרנה חוזרת, המבוצעת באמצעות EBRT או ברכיתרפיה, יוחסה לכ-50% bRFS לאחר 5 שנים, לעיתים במחיר של רעילות חמורה לטווח ארוך הנגרמת על ידי קרינה. למרות שבספרות חסרים נתונים, השילוב של היפרתרמיה והקרנות טומן בחובו פוטנציאל לשפר את השליטה במחלות ללא צורך בהעלאת מינון ההקרנות, שלעתים קרובות מוגבל במצבים אלה על ידי הסיכון לגרימת רעילות חמורה לאיברים הסמוכים. ניסוי HETERERO המתמשך (NCT04889742) יספק ככל הנראה בעתיד הקרוב תובנות חדשות על תפקידו של שילוב טיפולים זה. בנוסף, השילוב של היפרתרמיה עם ברכיתרפיה נבחן כעת גם במסגרת ההצלה, בתוך שני ניסויים פרוספקטיביים מתמשכים בזרוע אחת (NCT02899221 ו- NCT03238066) (טבלה 2).
הקרנות למיטת הערמונית עם או ללא טיפול נוגד אנדרוגנים (ADT) הוא הטיפול העיקרי בחולים עם הישנות ביוכימית לאחר כריתה רדיקלית של הערמונית. השילוב של היפרתרמיה עם הקרנות מציע במסגרת זו חלופה טיפולית מושכת כדי להבטיח עמידות ממושכת בשליטה המקומית מבלי להגביר את הרעילות הנגרמת על ידי קרינה הצפויה עם העלאת המינון. עם פרסום תוצאות הביניים, ניסוי שלב II של היפרתרמיה-ערמונית (NCT0415905) עדיין מגייס מטופלים עם הישנות ביוכימית לאחר כריתת ערמונית רדיקלית, עם נקודת סיום עיקרית של סבילות אקוטית. מכיוון שהקרנות למיטת הערמונית קשורה לשיעורים גבוהים של רעילות מערכת המין והשתן, הן במסגרת האדג'ובנטית והן בהצלה (54% ו-70% מהרעילות בדרגה ≥2 שדווחה בניסוי ANZUP RAVES שפורסם לאחרונה), השילוב של היפרתרמיה עם הקרנות עשוי גם לייצג אסטרטגיה משכנעת להפחתת מינון ההקרנות תוך הבטחת אותו שיעור bRFS כמו של מינוני הקרנות סטנדרטיים למיטת הערמונית. באופן דומה, נוכחות של הישנות מקומית מקרוסקופית בתוך מיטת הערמונית עשויה לייצג מצב קליני נוסף שעבורו ניתן לשפר את השליטה המקומית ארוכת הטווח על ידי אסטרטגיה משולבת זו.
מגבלותיה של סקירה שיטתית זו כוללות את האופי הרטרוספקטיבי והלא אקראי של המחקרים המדווחים, כמו גם את מועד פרסומם. ואכן, רבים מהמחקרים שבוצעו על סרטן הערמונית נערכו בשנות ה-90, ורוב טיפולי ההקרנות בוצעו בטכניקות דו-ממדיות או תלת-ממדיות, במינונים נמוכים מהסטנדרטים הנוכחיים. כל ההטיות הללו היו יכולות אפוא להשפיע לרעה על התוקף החיצוני של מחקרים אלה. יתר על כן, ייתכן שהיעדר נתונים על השימוש בטיפול נוגד אנדרוגנים ומשך הזמן במחקרים רבים פגע במסקנות החוקרים לגבי שליטה ארוכת טווח במחלות באסטרטגיה משולבת זו.
מסקנות
בהנחה של יתרון המינון הצפוי של 10 Gy או יותר, התוספת של היפרתרמיה להקרנות מייצגת אסטרטגיית טיפול מבטיחה לשיפור התוצאות מבלי להגדיל את הרעילות הקשורה לטיפול בחולי סרטן הערמונית המטופלים בהקרנות קורטיביות. חולים בסיכון גבוה יותר להישנות מקומית, כולל אלה עם מחלה בסיכון גבוה או גבוה מאוד, עם הישנות מקומית מקרוסקופית לאחר כריתת ערמונית רדיקלית, או עם הישנות גידולים לאחר טיפול בהקרנות מייצגים כנראה את המועמדים האופטימליים לטיפול משולב זה. על ידי יישום התפתחויות טכנולוגיות חדשות הן בטכניקות המתן של היפרתרמיה והקרנות, תוצאות של ניסויים אקראיים פרוספקטיביים מחכות על מנת להגדיר את תפקידה של אסטרטגיית טיפול זו בניהול התרפויטי של סרטן הערמונית.



